
第八章配位化合物 8-1配合物的基本概念 81-1配合物的组成 向硫酸铜溶液中滴加氨水,开始有蓝色的碱式硫酸铜沉淀Cu,(OH2S0,生 成。当氨水过量时,蓝色沉淀消失,变成深蓝色的溶液。往该深蓝色溶液中加入 乙醇,立即有深蓝色晶体析出。通过化学分析确定其组成为CuSO44 NH:H2O。 利用X射线结构分析技术确知晶体中四个NH与一个Cu+互相结合,形成复杂 离子CuNH)42+。这类复杂离子称为配离子。由配离子形成的配合物,如 ICu(NH):JSO 4和KPCN是由内界和外界两部分组成的。内界为配合物的特 征部分,是中心离子和配体之间通过配位键结合而成的 一个相当稳定的整体,在 配合物化学式中以方括号标明。方括号外的离子,离中心较远,构成外界。内界 与外界之间以离子键结合。 ICu(NHs)JSO K[Fe(CN)6l 内界 外界 外界 内界 [Cu(NH3) S02 (K)4 [Fe(CN)6 中心离子 配体 中心离子 配休 Cu2 (NHa) Fe (CN) 配位原子L配位数 配位原子刊'L配位数 有些配合物不存在外界,如PtC2(NH2l、[CoC13NH3等。另外,有些配 合物是由中心原子与配体构成,如Ni(CO4小、Fe(CO)]等。 1.形成体 中心高子或中心原子统称为配合物的形成体。中心离子绝大多数是带正电荷 的阳离子,其中以过渡金属离子居多,如Fe、Cu2、Co、Ag等;少数高氧 化态的非金属元素也可作中心离子,如BF4、S证62中的B(、SiV)等。中心 原子如Ni(CO))、Fe(CO)sl中的Ni、Fe原子. 2.配位个体 配位体及配位原子 由形成体结 定数 目的 位体所形成的结构单元称为配位个体,如 [CuNH)42+、Ni(CO)]等。凡含有配位个体的化合物统称为配合物。在配合物 中与形成体结合的离子或中性分子称为配位体,简称配体,如[CuNH)4中的 NH3、F(CN)J中的CN等。在配体中提供孤对电子与形成体形成配位键的原 子称为配位原子,如配体NH中的N。常见的配位原子为电负性较大的非金属 原子N、 C和卤素等 根据一个配体中所含配位原子数目的不同,可将配体分为单齿配体和多齿配 体。 单齿配体:一个配体中只有一个配位原子,如NH,OH,X,CN,SCN 等。 ①SCN中含有S和N两个不同的配位原子,在形成配合物时,只有一个 配位原子与形成体结合。如在Fe(NCS)+中,N作配位原子,在Ag(SCN2中
第八章 配位化合物 8-1 配合物的基本概念 8-1-1 配合物的组成 向硫酸铜溶液中滴加氨水,开始有蓝色的碱式硫酸铜沉淀 Cu2(OH)2SO4生 成。当氨水过量时,蓝色沉淀消失,变成深蓝色的溶液。往该深蓝色溶液中加入 乙醇,立即有深蓝色晶体析出。通过化学分析确定其组成为 CuSO4·4NH3·H2O。 利用 X 射线结构分析技术确知晶体中四个 NH3 与一个 Cu2+互相结合,形成复杂 离子[Cu(NH3)4] 2+。这类复杂离子称为配离子。由配离子形成的配合物,如 [Cu(NH3)4]SO4和 K4[Fe(CN)6]是由内界和外界两部分组成的。内界为配合物的特 征部分,是中心离子和配体之间通过配位键结合而成的一个相当稳定的整体,在 配合物化学式中以方括号标明。方括号外的离子,离中心较远,构成外界。内界 与外界之间以离子键结合。 [Cu(NH3)4]SO4 K4[Fe(CN)6] ┌──┴ ──┐ ┌──┴ ──┐ 内界 外界 外界 内界 [Cu(NH3)4] 2+ SO4 2- (K+ )4 [Fe(CN)6] 4- ┌──┴ ──┐ ┌──┴ ──┐ 中心离子 配体 中心离子 配体 Cu2+ (NH3)4 Fe3+ (CN - )6 ↑ ↑ ↑ ↑ 配位原子┘ └配位数 配位原子┘ └配位数 有些配合物不存在外界,如[PtCl2(NH3)2]、[CoCl3(NH3)3]等。另外,有些配 合物是由中心原子与配体构成,如[Ni(CO)4]、[Fe(CO)5]等。 1.形成体 中心离子或中心原子统称为配合物的形成体。中心离子绝大多数是带正电荷 的阳离子,其中以过渡金属离子居多,如 Fe3+、Cu2+、Co2+、Ag+等;少数高氧 化态的非金属元素也可作中心离子,如 BF4 -、SiF6 2-中的 B(Ⅲ)、Si(Ⅳ)等。中心 原子如[Ni(CO)4)、[Fe(CO)5]中的 Ni、Fe 原子。 2. 配位个体、配位体及配位原子 由形成体结合一定数目的配位体所形成的结构单元称为配位个体,如 [Cu(NH3)4] 2+ 、[Ni(CO)4]等。凡含有配位个体的化合物统称为配合物。在配合物 中与形成体结合的离子或中性分子称为配位体,简称配体,如[Cu(NH3)4] 2+中的 NH3、[Fe(CN)6] 3-中的 CN-等。在配体中提供孤对电子与形成体形成配位键的原 子称为配位原子,如配体 NH3中的 N。常见的配位原子为电负性较大的非金属 原子 N、O、S、C 和卤素等原子。 根据一个配体中所含配位原子数目的不同,可将配体分为单齿配体和多齿配 体。 单齿配体:一个配体中只有一个配位原子,如 NH3,OH-,X -,CN-,SCN-① 等。 ① SCN-中含有 S 和 N 两个不同的配位原子,在形成配合物时,只有一个 配位原子与形成体结合。如在[Fe(NCS)]2+ 中,N 作配位原子,在[Ag(SCN)2] -中

S作配位原子。像SCN这样的配体称为两可配体,属于两可配体的还有CN, NO2等。 多齿配体: 个配体中有两个或两个以上的配位原子,如表8所示。 表81常见的配体 ■中性分子配体配位原子阴离子配体配位原子阴离子配体配位原子 0水 0 F-氟 F CN.氰 齿NH;氨 N C1-氨 CI NO”酯基 N 配CO器共 Br-溴 Br ONO亚硝酸根 0 体CHNH,甲胺 SCN硫氰酸根 OH.羟基 0 NCS异硫氰酸根 N 分子式 名称 缩写符号 草酸根 (OX) 0 0 H2C-CH2 乙二胺 (en) H2N::NH2 P 邻菲罗啉 (O-phen) D 联吡啶 (bpy) 乙二胺四乙酸(Hjedta) nioccit: CCOUH 例如:()单齿配体NH,Ag+2NH→HN:一Ag←-NH (2)多齿配体乙二胺 CH2-HN NH2-CH rCH2-H2N: NH2-CH;12 +Cu2++ Cu CH2-HN NH,-CH, L CH2-H2N: NH2-CH; 3.配位数 在配位个体中与一个形成体成键的配位原子的总数称为该形成体的配位数 例如[CuNH中 Cu2的配位数为4,[CoCl(NH)]叫 Co 的配6 数为6 前己知形成体的配位数有1到14,其中最常见的配位数为6和4。由单齿配体形 成的配合物,中心离子的配位数等于配体的数目:若配体是多齿的,那么配体的 数目不等于中心离子的配位数。例如,[Cu(en22+中的乙二胺(en)是双齿配体,即 每1个en有2个N原子与中心离子Cu2配位,在此,Cu2的配位数是4而不是 2。表8-2列出一些常见离子的配位数
S 作配位原子。像 SCN-这样的配体称为两可配体,属于两可配体的还有 CN-, NO2 -等。 多齿配体:一个配体中有两个或两个以上的配位原子,如表 8-1 所示。 表 8-1 常见的配体 中性分子配体 配位原子 阴离子配体 配位原子 阴离子配体 配位原子 H20 水 O F-氟 F CN- 氰 C NH3 氨 N Cl- 氯 Cl NO2 - 硝基 N CO 羰基 C Br- 溴 Br ONO- 亚硝酸根 O CH3NH2 甲胺 N I- 碘 I SCN- 硫氰酸根 S 单 齿 配 体 OH- 羟基 O NCS-异硫氰酸根 N 分子式 名称 缩写符号 草酸根 (OX) H2C─CH2 │ │ H2N: :NH2 乙二胺 (en) 邻菲罗啉 (O-phen) 联吡啶 (bpy) 多 齿 配 体 乙二胺四乙酸 (H4edta) 例如:(1) 单齿配体 NH3 Ag+ + 2NH3 → [H3N:→ Ag ← :NH3] + (2) 多齿配体 乙二胺 CH2-H2N │ CH2-H2N + Cu2+ + NH2-CH2 │ ─→ NH2-CH2 ┌ │ └ CH2-H2N: :NH2-CH3 │ Cu │ CH2-H2N: :NH2-CH3 ┐ 2+ │ ┘ 3. 配位数 在配位个体中与一个形成体成键的配位原子的总数称为该形成体的配位数。 例如[Cu(NH3)4] 2+中,Cu2+的配位数为 4; [CoCl3(NH3)3]中 Co3+的配位数为 6。目 前已知形成体的配位数有 1 到 14,其中最常见的配位数为 6 和 4。由单齿配体形 成的配合物,中心离子的配位数等于配体的数目;若配体是多齿的,那么配体的 数目不等于中心离子的配位数。例如,[Cu(en)2] 2+中的乙二胺(en)是双齿配体,即 每 1 个 en 有 2 个 N 原子与中心离子 Cu2+配位,在此,Cu2+的配位数是 4 而不是 2。表 8-2 列出一些常见离子的配位数
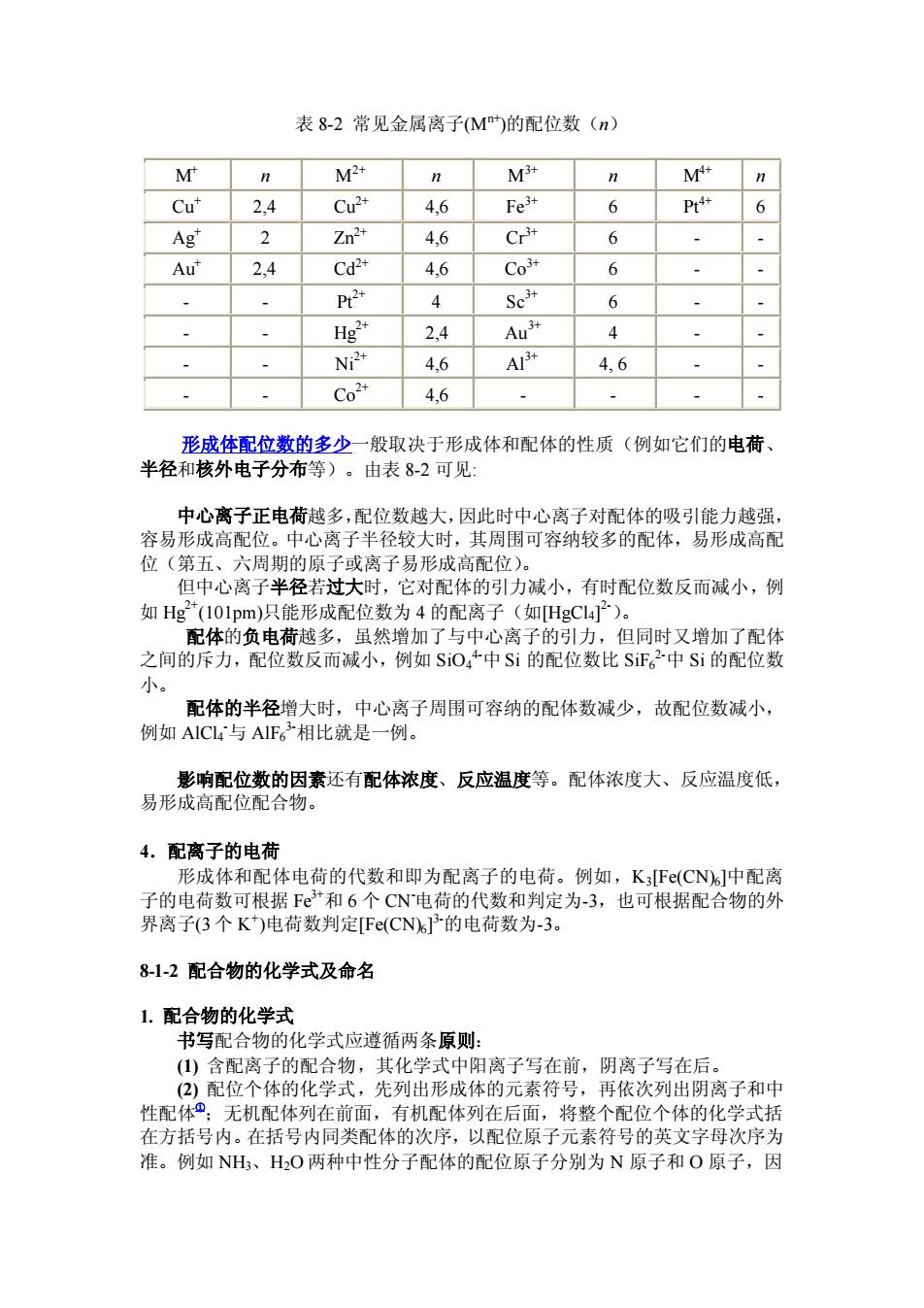
表8-2常见金属离子M的配位数(n) M M2+ n M n M n Cu" 2,4 Cu2 4,6 P+ 6 Ag' 2 7n2+ 4.6 Cr3升 6 Au 2.4 Cd2+ 4.6 Co 6 P2 4 Sc 6 Hg? 2.4 Au 4 4,6 46 4,6 形成体配位数的多少一般取决于形成体和配体的性质(例如它们的电荷、 半径和核外电子分布等)。由表8-2可见: 心离子正电荷越多,配位数越大,因此时中心离子对配体的吸引能力越强 容易 高面 心离子半径较大时 其周围可容纳较多的配体, 易形成高配 位(第五、六周 原 子或离子易形成高配位) 但中心离子半径若过大时,它对配体的引力减小,有时配位数反而减小,例 如Hg2*(101pm)只能形成配位数为4的配离子(如HgC14子)。 配体的负电荷越多,虽然增加了与中心离子的引力,但同时又增加了配体 之间的斥力,配位数反而减小,例如SO,+中Si的配位数比SiF。中Si的配位数 小。 配体的半径增大时,中心离子周围可容纳的配体数减少,故配位数减小, 例如AIC与AIF。相比就是一例。 影响配位数的因素还有配体浓度、反应温度等。配体浓度大、反应温度低, 易形成高配位配合物。 4.配离子的电荷 形成体和配体电荷的代数和即为配离子的电荷。例如,KF©(CN)中配离 子的电荷数可根据Fe和6个CN电荷的代数和判定为-3,也可根据配合物的外 界离子(3个K)电荷数判定Fe(CN6产的电荷数为-3。 812配合物的化学式及命名 1.配合物的化学式 书写配合物的化学式应遵循两条原则: ()含配离子的配合物,其化学式中阳离子写在前,阴离子写在后。 (2)配位个体的化学式,先列出形成体的元素符号,再依次列出阴离子和中 性配体@:无机配体列在前面,有机配体列在后面,将整个配位个体的化学式括 在方括号内。在括号内同类配体的次序,以配位原子元素符号的英文字母次序为 准。例如NH、HO两种中性分子配体的配位原子分别为N原子和O原子,因
表 8-2 常见金属离子(Mn+)的配位数(n) M+ n M2+ n M3+ n M4+ n Cu+ 2,4 Cu2+ 4,6 Fe3+ 6 Pt4+ 6 Ag+ 2 Zn2+ 4,6 Cr3+ 6 - - Au+ 2,4 Cd2+ 4,6 Co3+ 6 - - - - Pt2+ 4 Sc3+ 6 - - - - Hg2+ 2,4 Au3+ 4 - - - - Ni2+ 4,6 Al3+ 4, 6 - - - - Co2+ 4,6 - - - - 形成体配位数的多少一般取决于形成体和配体的性质(例如它们的电荷、 半径和核外电子分布等)。由表 8-2 可见: 中心离子正电荷越多,配位数越大,因此时中心离子对配体的吸引能力越强, 容易形成高配位。中心离子半径较大时,其周围可容纳较多的配体,易形成高配 位(第五、六周期的原子或离子易形成高配位)。 但中心离子半径若过大时,它对配体的引力减小,有时配位数反而减小,例 如 Hg2+(101pm)只能形成配位数为 4 的配离子(如[HgCl4] 2-)。 配体的负电荷越多,虽然增加了与中心离子的引力,但同时又增加了配体 之间的斥力,配位数反而减小,例如 SiO4 4-中Si 的配位数比 SiF6 2-中 Si 的配位数 小。 配体的半径增大时,中心离子周围可容纳的配体数减少,故配位数减小, 例如 AlCl4 -与 AlF6 3-相比就是一例。 影响配位数的因素还有配体浓度、反应温度等。配体浓度大、反应温度低, 易形成高配位配合物。 4.配离子的电荷 形成体和配体电荷的代数和即为配离子的电荷。例如,K3[Fe(CN)6]中配离 子的电荷数可根据 Fe3+和 6 个 CN-电荷的代数和判定为-3,也可根据配合物的外 界离子(3 个 K + )电荷数判定[Fe(CN)6] 3-的电荷数为-3。 8-1-2 配合物的化学式及命名 1. 配合物的化学式 书写配合物的化学式应遵循两条原则: (1) 含配离子的配合物,其化学式中阳离子写在前,阴离子写在后。 (2) 配位个体的化学式,先列出形成体的元素符号,再依次列出阴离子和中 性配体① ;无机配体列在前面,有机配体列在后面,将整个配位个体的化学式括 在方括号内。在括号内同类配体的次序,以配位原子元素符号的英文字母次序为 准。例如 NH3、H2O 两种中性分子配体的配位原子分别为 N 原子和 O 原子,因

而NH写在H,O之前 2.配合物的命名 配合物的命名方法基本上遵循一般无机物的命名原则,若配合物为配离子化 合物,则命名时阴离子在前,阳离子在后,与无机盐的命名一样。若为配阳离子 化合物,则叫做某化某或某酸某。若为配阴离子化合物,则在配阴离子与外界阳 离子之间用“酸字连接,若外界为氢离子,则在配阴离子之后缀以“酸字。 配 位个体按照以下原则进行 ()配体名称列在形成体名称之前。不同配体名称的顺序同书写顺序,相互 之间以黑点“”分开,在最后一个配体名称之后缀以“合”字。 2)同类配体的名称按配位原子元素符号的英文字母顺序排列。 3)配体个数用倍数词头二、三、四等数字表示。形成体的氧化数用带括号 的罗马数字表示。 3.配体的命名 ()带倍数词头的无机含氧酸根阴离子配体,命名时要用括号括起来,如: (三磷酸根)。有的无机含氧酸阴离子,即使不含倍数词头,但含有一个以上代 酸原子,也要用括号,如: (硫代硫酸根) 2)有些配体具有相同的化学式,但由于配位原子不同,而有不同的命名 另外 某些分子或基团,作配体后读法上有所改变,例如表81中配体OO(O 为配位原子)称亚硝酸根,而NO2(N为配位原子)称硝基:SCN(S为配位房 子)称硫氰酸根,而NCSN为配位原子)称异硫氰酸根:CO称羰基、OH称羟 基等。 下面列举一些配合物命名的实例。 表8-3 一些配合物的化学式、系统命名示例 类别 化学式 系统命名 配位酸 H2[Si证6] 六氟合硅(V)酸 HPtCkI 六氯合铂(V)酸 配位碱[AgNH](O用 氢氧化二氨合银(I) 配位盐 [Cu(NH3)]SOa 硫酸四氨合铜(Ⅱ) [CrCls(H2O)4]CI 一氯化二氯四水合铬) [Co(NH3)(H2O)]CI3 三氯化五氨一水合钴() K4[Fe(CN)6] 六氧合铁(酸钾 Nas[Ag(S203)2] 二(硫代硫酸根)合银(I酸钠 K[PtCls(NH】 五氯一氨合铂(V)酸钾
而 NH3写在 H2O 之前。 2. 配合物的命名 配合物的命名方法基本上遵循一般无机物的命名原则。若配合物为配离子化 合物,则命名时阴离子在前,阳离子在后,与无机盐的命名一样。若为配阳离子 化合物,则叫做某化某或某酸某。若为配阴离子化合物,则在配阴离子与外界阳 离子之间用“酸”字连接,若外界为氢离子,则在配阴离子之后缀以“酸”字。 配 位个体按照以下原则进行命名: (1) 配体名称列在形成体名称之前。不同配体名称的顺序同书写顺序,相互 之间以黑点“·”分开,在最后一个配体名称之后缀以“合”字。 (2) 同类配体的名称按配位原子元素符号的英文字母顺序排列。 (3) 配体个数用倍数词头二、三、四等数字表示。形成体的氧化数用带括号 的罗马数字表示。 3. 配体的命名 (1) 带倍数词头的无机含氧酸根阴离子配体,命名时要用括号括起来,如: (三磷酸根)。有的无机含氧酸阴离子,即使不含倍数词头,但含有一个以上代 酸原子,也要用括号,如:(硫代硫酸根)。 (2) 有些配体具有相同的化学式,但由于配位原子不同,而有不同的命名。 另外,某些分子或基团,作配体后读法上有所改变,例如表 8-1 中配体 ONO- (O 为配位原子)称亚硝酸根,而 NO2 -(N 为配位原子)称硝基;SCN- (S 为配位原 子)称硫氰酸根,而 NCS- (N 为配位原子)称异硫氰酸根;CO 称羰基、OH-称羟 基等。 下面列举一些配合物命名的实例。 表 8-3 一些配合物的化学式、系统命名示例 类别 化学式 系统命名 H2[SiF6] 六氟合硅(Ⅳ)酸 配位酸 H2[PtCl6] 六氯合铂(Ⅳ)酸 配位碱 [Ag(NH3)2](OH) 氢氧化二氨合银(Ⅰ) [Cu(NH3)4]SO4 硫酸四氨合铜(Ⅱ) [CrCl3(H2O)4]Cl 一氯化二氯·四水合铬(Ⅲ) [Co(NH3)5(H2O)]Cl3 三氯化五氨·一水合钴(Ⅲ) K4[Fe(CN)6] 六氰合铁(Ⅱ)酸钾 Na3[Ag(S2O3)2] 二(硫代硫酸根)合银(Ⅰ)酸钠 配位盐 K[PtCl5(NH3)] 五氯·一氨合铂(Ⅳ)酸钾

NH4[Cr(NCS)4NH为四(异硫氰酸根)二氨合铬(Ⅲ)酸铵 Fe(CO)s] 五羰基合铁 中性分子 [PtCl4(NH3)2] 四氯二氨合铂(V) [Co(NO2(NHs)3] 三硝基三氨合钴(山 8-2 配合物的化学键理论 由于价键理论简单明了,又能解决 一些问题,如它可以解释配离子的几何构 型,形成体的配位数以及配合物的某些化学性质和磁性,所以它有一定的用途。 但是这个理论也有缺陷,它忽略了配体对形成体的作用。而且到目前为止还不能 定量地说明配合物的性质。如无法定量地说明过渡金属配离子的稳定性随中心离 子的d电子数变化而变化的事实。也不能解释配离子的吸收光谱和特征颜色(如 T(H20)6]3+为何显紫红色)此外,价键理论根据磁矩虽然可区分中心离子d4 d7构型的八面体配合物属内轨型还是外轨型,但对具有d1,d2,d3和d9构型 的中心离子所形成的配合物,因未成对电子数无论在内轨型还是外轨型配合物中 均无差别,只根据磁矩仍无法区别。 配合物是内轨型还是外轨型,主要取决于中心高子的电子构型,高子所带的 电荷和配位原子的电负性大小。 具有d 构型的离子,只能用外层轨道形成外轨型配合物: 具有d8构型的离子如N2+,P+,P2+等,在大多数情况下形成内轨型配合 物, 具有d构型的离子,既可形成内轨型,也可形成外轨型配合物。 中心离子的电荷增多有利于形成内轨型配合物。因为中心离子的电荷较多 时,它对配位原 的孤电子对引力增强,利于以其内层轨道参与成键。例如 [CoNH)62+为外轨型,而[CoNH63+为内轨型。 电负性大的原子如F,O等,与电负性较小的C原子比较,通常不易提供孤 电子对,它们作为配位原子时,中心离子以外层轨道与之成键,因而形成外轨型 配合物。C原子作为配位原子时(如在CN中)则常形成内轨型配合物。 821配合物的价健理 近代配合物价健理论基本要点是:形成配合物时,形成体(M)的某些价层 原子轨道在配体(L)作用下进行杂化,用空的杂化轨道接受配体提供的孤对电 子,以。配位键(M←-L)的方式结合。从近代结构理论的观点来说,亦即形成 体的杂化轨道与配位原子的某个孤对电子原子轨道相互重叠,形成配位键。因 配合物是由形成体与配体以配位键结合而成的复杂化合物 1.配合物的几何构型和配位键 (1)几何构型 由于形成体的杂化轨道都具有一定的方向性,所以配合物具有一定的几何构 型,如表8-4所示。 表8-4轨道杂化类型与配位个体的几何构型
NH4[Cr(NCS)4(NH3)2] 四(异硫氰酸根)·二氨合铬(Ⅲ)酸铵 [Fe(CO)5] 五羰基合铁 中性分子 [PtCl4(NH3)2] 四氯·二氨合铂(Ⅳ) [Co(NO2)3(NH3)3] 三硝基·三氨合钴(Ⅲ) 8-2 配合物的化学键理论 由于价键理论简单明了,又能解决一些问题,如它可以解释配离子的几何构 型,形成体的配位数以及配合物的某些化学性质和磁性,所以它有一定的用途。 但是这个理论也有缺陷,它忽略了配体对形成体的作用。而且到目前为止还不能 定量地说明配合物的性质。如无法定量地说明过渡金属配离子的稳定性随中心离 子的 d 电子数变化而变化的事实。也不能解释配离子的吸收光谱和特征颜色(如 [Ti(H2O)6]3+为何显紫红色)。此外,价键理论根据磁矩虽然可区分中心离子 d4~ d7 构型的八面体配合物属内轨型还是外轨型,但对具有 d1,d2,d3 和 d9 构型 的中心离子所形成的配合物,因未成对电子数无论在内轨型还是外轨型配合物中 均无差别,只根据磁矩仍无法区别。 配合物是内轨型还是外轨型,主要取决于中心离子的电子构型,离子所带的 电荷和配位原子的电负性大小。 具有 d 10 构型的离子,只能用外层轨道形成外轨型配合物; 具有 d 8构型的离子如 Ni2+,Pt2+,Pd2+等,在大多数情况下形成内轨型配合 物; 具有 d 4~d 7 构型的离子,既可形成内轨型,也可形成外轨型配合物。 中心离子的电荷增多有利于形成内轨型配合物。因为中心离子的电荷较多 时,它对配位原子的孤电子对引力增强,利于以其内层 d 轨道参与成键。例如 [Co(NH3)6] 2+为外轨型,而[Co(NH3)6] 3+为内轨型。 电负性大的原子如 F,O 等,与电负性较小的 C 原子比较,通常不易提供孤 电子对,它们作为配位原子时,中心离子以外层轨道与之成键,因而形成外轨型 配合物。C 原子作为配位原子时(如在 CN-中)则常形成内轨型配合物。 8-2-1 配合物的价键理论 近代配合物价键理论基本要点是:形成配合物时,形成体(M)的某些价层 原子轨道在配体(L)作用下进行杂化,用空的杂化轨道接受配体提供的孤对电 子,以 σ配位键(M← :L)的方式结合。从近代结构理论的观点来说,亦即形成 体的杂化轨道与配位原子的某个孤对电子原子轨道相互重叠,形成配位键。因 而,配合物是由形成体与配体以配位键结合而成的复杂化合物。 1. 配合物的几何构型和配位键 (1)几何构型 由于形成体的杂化轨道都具有一定的方向性,所以配合物具有一定的几何构 型,如表 8-4 所示。 表 8-4 轨道杂化类型与配位个体的几何构型