
第十章碱金属和碱土金属元素 本章将重点介绍碱金属和碱土金属单质、各类氧化物、氢氧化物、盐类的性 质及几种典型盐的生产。 91s区元素概述 s区元素包括周期表中IA和ⅡA族。IA族由锂、钠、钾、铷、铯及纺六 种元素组成。由于钠和钾的氢氧化物是典型的碱”,故本族元素有碱金属之称。 锂、铷、铯是轻稀有金属:钫是放射性元素。ⅡA族由铍、镁、钙、锶、钡及铺 由于钙、锶、钡的氧化物性质介于“碱族与“士族元素之间, 故有碱土金属之 现在习惯上把皱和镁也包括在碱土金属之内。皱也属于轻稀有金属,镭是放 射性元素。锂最重要的矿石是锂辉石(LiAlSi2O6)。钠主要以NaCI形式存在于海 洋、盐湖及岩石中。钾的主要矿物是钾石盐(2 KCI-MgCh6H2O),我国青海钾盐 储量占全国96.8%。铍的主要矿物是绿柱石(3B0A12036S1O2, 见右图。样主: 要以菱镁矿(MgCO)、 I云石MgCa(COh]形式存在。 钡以碳酸盐、硫 酸盐形式存在,如方解石(CaCO)、石膏(CaSO42H2O)、天青石(SrS04以重品石 (BaSO4). ①第Ⅲ八族元素有时称为土族元素,其中铝最典型,铝的氧化物(为粘士的主 要成分)既难容又难熔,故有十金屈之称 9-2碱金属和碱土金属的性质 碱金属和碱土金属元素的一些基本性质,分别列于表10-1和表10-2中。 表10-1碱金属元素的性质 元素 锂(Li)钠Na)钾(K) 铷(Rb)铯(CS) 原子字数 3 11 19 37 55 价层电子构型 2 3s 4s' 5s' 6s 主要氧化数 +1 +1 +1 +1 +1 固体密度/(gcm),20℃ 0.530.970.86 1.53 1.88 熔点rC 180.597,8263.25 38.89 28.40 沸占℃ 1342 882.9 760 686 669.3 硬度(金刚石=10) 0.6 0.4 0.5 0.3 0.2 金属半径pm 152 186 227 248 265 离子半径pm 76 102 138 152 167 第一电离能(lmol) 520 496 419 403 376 第一电离能(Jmol) 7298 4562 3051 2632 2234
第十章 碱金属和碱土金属元素 本章将重点介绍碱金属和碱土金属单质、各类氧化物、氢氧化物、盐类的性 质及几种典型盐的生产。 9-1 s 区元素概述 s 区元素包括周期表中ⅠA 和ⅡA 族。ⅠA 族由锂、钠、钾、铷、铯及钫六 种元素组成。由于钠和钾的氢氧化物是典型的“碱”,故本族元素有碱金属之称。 锂、铷、铯是轻稀有金属;钫是放射性元素。ⅡA 族由铍、镁、钙、锶、钡及镭 六种元素组成。由于钙、锶、钡的氧化物性质介于“碱”族与“土”族元素” ①之间, 故有碱土金属之称。 现在习惯上把铍和镁也包括在碱土金属之内。铍也属于轻稀有金属,镭是放 射性元素。锂最重要的矿石是锂辉石(LiAlSi2O6)。钠主要以 NaCl 形式存在于海 洋、盐湖及岩石中。钾的主要矿物是钾石盐(2KCI·MgCl2·6H2O), 我国青海钾盐 储量占全国 96.8%。铍的主要矿物是绿柱石(3BeO·A12O3·6S1O2, 见右图)。镁主 要以菱镁矿(MgCO3)、白云石[MgCa(CO3)2]形式存在。钙、锶、钡以碳酸盐、硫 酸盐形式存在,如方解石(CaCO3)、石膏(CaSO4·2H2O)、天青石(SrSO4)、重晶石 (BaSO4)。 ① 第ⅢA 族元素有时称为土族元素,其中铝最典型,铝的氧化物(为粘土的主 要成分)既难溶又难熔,故有土金属之称。 9-2 碱金属和碱土金属的性质 碱金属和碱土金属元素的一些基本性质,分别列于表 10-1 和表 10-2 中。 表 10-1 碱金属元素的性质 元 素 锂(Li) 钠(Na) 钾(K) 铷(Rb) 铯(Cs) 原子序数 3 11 19 37 55 价层电子构型 2s1 3s1 4s1 5s1 6s1 主要氧化数 +1 +1 +1 +1 +1 固体密度/(g·cm-3 ),20℃ 0.53 0.97 0.86 1.53 1.88 熔点/℃ 180.5 97,82 63.25 38.89 28.40 沸点/℃ 1342 882.9 760 686 669.3 硬度(金刚石=10) 0.6 0.4 0.5 0.3 0.2 金属半径/pm 152 186 227 248 265 离子半径/pm 76 102 138 152 167 第一电离能(I1/kJ·mol-1 ) 520 496 419 403 376 第一电离能(I2/kJ·mol-1 ) 7298 4562 3051 2632 2234

电负性 1.0 0.9 0.8 0.8 0.7 E(M'/M)/V 3.040 2.713 -2.924 (-2.98)(-3.026) 表102碱土金属元素的性质 元素 铍(Be)镁Mg)钙(Ca)锶(Sr) 钡(Ba) 原子序数 4 12 20 38 56 价层电子构型 252 352 4s2 5s2 6S2 主要氧化数 +2 +2 +2 +2 +2 固体密度 /kgcm3).20℃ 1.85 1.74 1.54 2.6 3.51 熔点/℃ 1278648.8839 769 725 沸点/℃ 2970 11071484 1384 1640 硬度(金刚石=10) 4 2.0 1.5 1.8 金属半径pm 111 160 197 215 217 离子半径pn 45 72 100 118 136 第一电离能 I/(kJmol) g 738 590 549 503 第二电离能 /(kJmol-) 1757 1451 1145 1064 965 第三电离能 14849 I /(kJmol) 7733 4912 4138 电负性 1.5 12 10 10 09 E(M2/M)/V -1.99-2.356-2.84 -2.89-2.92 IA和ⅡA族元素的原子最外层分别只有1~2个s电子,在同一周期中这 些原子具有较大的原子半径和较少的核电荷,故IA、HA族金属晶体中的金属键 很不牢固,单质的熔、沸点较低,硬度较小。由于碱土金属比碱金属原子半径小, 核电荷多,因此碱土金属的熔点和沸点都比碱金属高,密度和硬度比碱金属大。 碱金属和Ca、Sr、Ba均可用刀切割 碱金属和碱土金属表面都具有银白色光泽,在同周期中碱金属是金属性最强 的元素,碱土金属逊于碱金属,在同族元素中随原子序数增加,元素的金属性依 次递增。碱金属尤其是Cs和Rb,失去电子的倾向很大,当受到光的照射时,金 属表面的电子易逸出,因此,常用来制造光电管。如铯光电管制成的自动报警装 置,可 :制成的天文仪器可根据由星光转变的电流大小测出 大空中 星体的亮度,推算出星体与地球的距离
电负性 1.0 0.9 0.8 0.8 0.7 E θ (M+ /M)/V -3.040 -2.713 -2.924 (-2.98) (-3.026) 表 10-2 碱土金属元素的性质 元 素 铍(Be) 镁(Mg) 钙(Ca) 锶(Sr) 钡(Ba) 原子序数 4 12 20 38 56 价层电子构型 2s2 3s2 4s2 5s2 6S2 主要氧化数 +2 +2 +2 +2 +2 固体密度 /(kg·cm-3 ),20℃ 1.85 1.74 1.54 2.6 3.51 熔点/℃ 1278 648.8 839 769 725 沸点/℃ 2970 1107 1484 1384 1640 硬度(金刚石=10) 4 2.0 1.5 1.8 - 金属半径/pm 111 160 197 215 217 离子半径/pm 45 72 100 118 136 第一电离能 I1/(kJ·mol-1 ) 899 738 590 549 503 第二电离能 I2/(kJ·mol-1 ) 1757 1451 1145 1064 965 第三电离能 I3/(kJ·mol-1 ) 14849 7733 4912 4138 - 电负性 1.5 1.2 1.0 1.0 0.9 E θ (M2+/M)/V -1.99 -2.356 -2.84 -2.89 -2.92 ⅠA 和ⅡA 族元素的原子最外层分别只有 1~2 个 s 电子,在同一周期中这 些原子具有较大的原子半径和较少的核电荷,故 IA、HA 族金属晶体中的金属键 很不牢固,单质的熔、沸点较低,硬度较小。由于碱土金属比碱金属原子半径小, 核电荷多,因此碱土金属的熔点和沸点都比碱金属高,密度和硬度比碱金属大。 Li 的密度为 0.53kg·m-3,是最轻的金属。碱金属和 Ca、Sr、Ba 均可用刀切割, 其中最软的是 Cs。 碱金属和碱土金属表面都具有银白色光泽,在同周期中碱金属是金属性最强 的元素,碱土金属逊于碱金属,在同族元素中随原子序数增加,元素的金属性依 次递增。碱金属尤其是 Cs 和 Rb,失去电子的倾向很大,当受到光的照射时,金 属表面的电子易逸出,因此,常用来制造光电管。如铯光电管制成的自动报警装 置,可报告远处火警;制成的天文仪器可根据由星光转变的电流大小测出太空中 星体的亮度,推算出星体与地球的距离
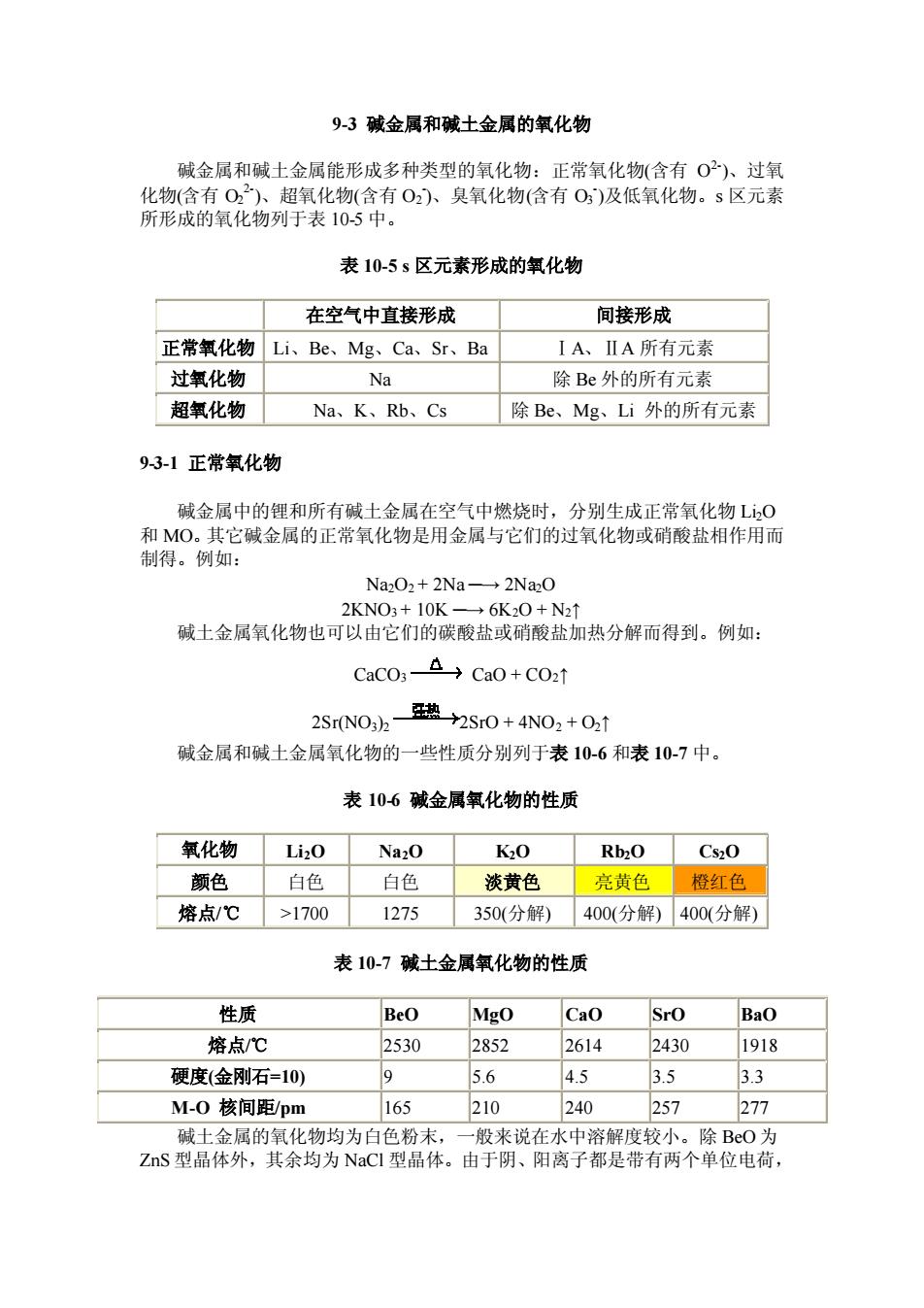
93碱金属和碱土金属的氧化物 碱金属和碱土金属能形成多种类型的氧化物:正常氧化物(含有O2)、过氧 货有装微行氧化物合有0及低氧化物。s区元 化物含有O: 表10-5s区元素形成的氧化物 在空气中直接形成 间接形成 正常氧化物Li、Be、Mg、Ca、Sr、Ba IA、ⅡA所有元素 过氧化物 Na 除Be外的所有元素 超氧化物 Na、K、Rb、Cs 除Be、Mg、Li外的所有元素 93-1正常氧化物 碱金属中的锂和所有碱土金属在空气中燃烧时,分别生成正常氧化物L0 和MO。其它碱金属的正常氧化物是用金屈与它们的过氧化物或硝酸盐相作用而 制得。例如: Na2O2+2Na-2Na2O 2KNO3+10K- →6K20+N2↑ 碱土金属氧化物也可以由它们的碳酸盐或硝酸盐加热分解而得到。例如: CaCO3- △→Ca0+C02t 2Sr(NO:)2- 热2Sr0+4NO2+02t 碱金属和碱土金属氧化物的一些性质分别列于表10-6和表10-7中。 表106碱金属氧化物的性质 氧化物 Na20 K20 Rb2O Cs20 颜色 白色 白色 淡黄色 亮黄色橙红色 熔点/℃ >1700 1275 350(分解)400(分解)400(分解) 表10-7碱土金属氧化物的性质 性质 BeO Mgo Cao Sro BaO 熔点/℃ 2530 2852 2614 2430 1918 硬度(金刚石-10) 9 56 4.5 3.5 33 M-0核间距pm 165 210 240 257 277 成十会屈的句化物的为白铅末. 一船来在水中溶解度小。除O头 ZS型晶体外,其余均为NaC型晶体。由于阴、阳离子都是带有两个单位电荷
9-3 碱金属和碱土金属的氧化物 碱金属和碱土金属能形成多种类型的氧化物:正常氧化物(含有 O 2- )、过氧 化物(含有 O2 2- )、超氧化物(含有 O2 - )、臭氧化物(含有 O3 - )及低氧化物。s 区元素 所形成的氧化物列于表 10-5 中。 表 10-5 s 区元素形成的氧化物 - 在空气中直接形成 间接形成 正常氧化物 Li、Be、Mg、Ca、Sr、Ba ⅠA、ⅡA 所有元素 过氧化物 Na 除 Be 外的所有元素 超氧化物 Na、K、Rb、Cs 除 Be、Mg、Li 外的所有元素 9-3-1 正常氧化物 碱金属中的锂和所有碱土金属在空气中燃烧时,分别生成正常氧化物 Li2O 和 MO。其它碱金属的正常氧化物是用金属与它们的过氧化物或硝酸盐相作用而 制得。例如: Na2O2 + 2Na ─→ 2Na2O 2KNO3 + 10K ─→ 6K2O + N2↑ 碱土金属氧化物也可以由它们的碳酸盐或硝酸盐加热分解而得到。例如: CaCO3 CaO + CO2↑ 2Sr(NO3)2 2SrO + 4NO2 + O2↑ 碱金属和碱土金属氧化物的一些性质分别列于表 10-6 和表 10-7 中。 表 10-6 碱金属氧化物的性质 氧化物 Li2O Na2O K2O Rb2O Cs2O 颜色 白色 白色 淡黄色 亮黄色 橙红色 熔点/℃ >1700 1275 350(分解) 400(分解) 400(分解) 表 10-7 碱土金属氧化物的性质 性质 BeO MgO CaO SrO BaO 熔点/℃ 2530 2852 2614 2430 1918 硬度(金刚石=10) 9 5.6 4.5 3.5 3.3 M-O 核间距/pm 165 210 240 257 277 碱土金属的氧化物均为白色粉末,一般来说在水中溶解度较小。除 BeO 为 ZnS 型晶体外,其余均为 NaCl 型晶体。由于阴、阳离子都是带有两个单位电荷

而且MO核间距又较小,MO具有较大晶格能,因此它们的硬度和熔点都很高。 根据这种特性,BeO和MgO常用来制造耐火材料和金属陶瓷。特别是BeO, 还具有反射放射性射线的能力 常用作原子反应堆外壁砖块材 氧化镁按制取工艺及产品的致密程度不同,有重质和轻质之分: MgO+HO一MgOH2A→MgO+HO (天然苦土粉) (重质 MgCl2+5Na2CO3+H2O -4MgCO3Mg(OH)2+10NaCl+CO2 一5Mg0+4CO2t+H20 轻质) 重质氧化镁水泥是一种很好的建筑材料,和木屑、刨花一起,可制成质轻 隔音、绝热、 耐火的纤维板 ,轻质氧化镁水泥比重质贵三信 是制坩埚的 和油漆、纸张的填料。CO是重要的建筑材料,在治炼厂中用作助溶剂,以除去 硫、磷、硅等杂质,在化工中用作制取电石(CC2)的原料,还可用作生产钙的化 学试剂、用于污水处理、造纸等,其产量仅次于硫酸。 93-2过氧化物和超氧化物 过氧化物是含有过氧基(-0-0-)的化合物,可看作是02的衍生物。除皱外, 所有碱金属和碱土金属都能形成离子型过氧化物。 除了锂、铍、镁外,碱金属和碱土金属都能形成超氧化物。其中钠、钾、铷、 铯在过量的氧气中燃烧可直接生成超氧化物。例如: 2 是化工中最常用的碱金属过氧化物。纯的NaO2为白色粉末 工业品 一般为浅黄色。工业上制备NO2是用熔钠与己除出二氧化碳的干燥空气反应: 2Na+02-Na202 纯净的NaO28H20是用饱和NaOH(纯级)溶液和42%HO2混合制得: 2NaOH+HOC Na:0:+2H2O NO2在碱性介质中是强氧化剂,常用于作熔矿剂,以使既不溶于水又不溶 于酸的矿石被氧化分解为可溶于水的化合物。例如: 2Fe(Cro+7Na20-4NaCrO+Fe2O3+3Na2O NaO2也用于纺织、纸浆的漂白。NaO2在熔融时几乎不分解,但遇到棉花、木 炭或铝粉等还原性物质时,就会发生爆炸,故使用NaO2时要特别小心 下,过氧化物、超氧化物与水或稀酸反应生成过氧化氢,过氧化氢又分 解而放出氧气: Na20+2H20-2NaOH+HO Na2O2 +H2SO-NazSOa+H2O2 2K02+2H0 →2KOH+H02+O2 2KO2+H2S04-→KS04+H02+O2↑ 2H202 一→H0+02↑ 过氧化物和超氧化物与二氧化碳反应放出氧气:
而且 M-O 核间距又较小,MO 具有较大晶格能,因此它们的硬度和熔点都很高。 根据这种特性,BeO 和 MgO 常用来制造耐火材料和金属陶瓷。特别是 BeO, 还具有反射放射性射线的能力,常用作原子反应堆外壁砖块材料。 氧化镁按制取工艺及产品的致密程度不同,有重质和轻质之分: MgO + H2O ─→ Mg(OH)2 MgO + H2O (天然苦土粉) (重质) MgCl 2 + 5Na 2CO3 + H2O ─→ 4MgCO3·Mg(OH)2 + 10NaCl + CO2↑ │△ └─→ 5MgO + 4CO2 ↑+ H2O (轻质) 重质氧化镁水泥是一种很好的建筑材料,和木屑、刨花一起,可制成质轻、 隔音、绝热、耐火的纤维板。轻质氧化镁水泥比重质贵三倍 ,是制坩埚的原料 和油漆、纸张的填料。CaO 是重要的建筑材料,在冶炼厂中用作助溶剂,以除去 硫、磷、硅等杂质,在化工中用作制取电石(CaC2)的原料, 还可用作生产钙的化 学试剂、用于污水处理、造纸等,其产量仅次于硫酸。 9-3-2 过氧化物和超氧化物 过氧化物是含有过氧基(-O-O-)的化合物,可看作是 H2O2的衍生物。除铍外, 所有碱金属和碱土金属都能形成离子型过氧化物。 除了锂、铍、镁外,碱金属和碱土金属都能形成超氧化物。其中钠、钾、铷、 铯在过量的氧气中燃烧可直接生成超氧化物。例如: K + O2 ─→ KO2 Na2O2是化工中最常用的碱金属过氧化物。纯的 Na2O2为白色粉末,工业品 一般为浅黄色。工业上制备 Na2O2是用熔钠与已除出二氧化碳的干燥空气反应: 2Na + O2 ─→ Na2O2 纯净的 Na2O2·8H2O 是用饱和 NaOH(纯级)溶液和 42%H2O2混合制得: 2NaOH + H2O2 Na2O2 + 2H2O Na2O2在碱性介质中是强氧化剂,常用于作熔矿剂,以使既不溶于水又不溶 于酸的矿石被氧化分解为可溶于水的化合物。例如: 2Fe(CrO2)2 + 7Na2O2 ─→ 4Na2CrO4 + Fe2O3 + 3Na2O Na2O2也用于纺织、纸浆的漂白。Na2O2 在熔融时几乎不分解,但遇到棉花、木 炭或铝粉等还原性物质时,就会发生爆炸,故使用 Na2O2时要特别小心。 室温下,过氧化物、超氧化物与水或稀酸反应生成过氧化氢,过氧化氢又分 解而放出氧气: Na2O2 + 2H2O ─→ 2NaOH + H2O2 Na2O2 + H2SO4 ─→ Na2SO4 + H2O2 2KO2 + 2H2O ─→ 2KOH + H2O2 + O2 ↑ 2KO2 + H2SO4 ─→ K2SO4 + H2O2 + O2 ↑ 2H2O2 ─→ H2O + O2 ↑ 过氧化物和超氧化物与二氧化碳反应放出氧气:

Na02+2C0-一NaC0+0t K02+2C02 2N,C03+302 因此,过氧化物和超氧化物常用作防毒面具、高空飞行、潜水的供氧剂。 93-3臭氧化物和*低氧化物 在低温下通过O,与粉末状无水碱金属(除L外)氢氧化物反应,并用液氨提 取,即可得到红色的MO3。固体: 3MOH(s)+203(g)-MO3(s)+MOH-H2O(s)+1/202(g) 室温下,臭氧化物缓慢分解为MO2和O2: M03-一2M02+1/202(g) 臭氧化物与水反应,则生成MOH和O2: 4M03+2Hh0+4MOH+5O2↑ Rb和Cs除可形成以上氧化物外,还可形成低氧化物,如低温时,Rb发生 不完全氧化可得到Rb6O,它在-7.3℃以上时分解为RbO2: 2Rb.02-15CRb,02+3Rb Cs可形成一系列低氧化物,如Cs0(青铜色)CsO(红紫色)Cs1O(紫色 晶体人Cs3+xO(为非化学计量物质)等。 9-4氢氧化物 碱金属和碱土金属的氧化物除BO、MgO外)与水作用,即可得到相应的 氢氧化物,并伴随着释放出大量热: M20 H2O-2MOH M20+H20-→2M(OH)2 碱金属和碱土金属的氢氧化物均为白色固体,易潮解,在空气中吸收CO2 生成碳酸盐。由于碱金属氢氧化物对纤维、皮肤有强烈的腐蚀作用,故称为苛性 941碱金属和碱土金属氢氧化物的碱性 碱金属和碱土金属氢氧化物除B(OH)2外]均呈碱性,同族元素氢氧化物的 碱性均随金属元素原子序数的增加而增强: LiOH NaOH KOH RbOH CSOH 中强碱强碱 强碱 强碱 强碱 Be(OH)Mg(OH CaOH Sr(OH Ba(OH 两性 中强减 强城 强减 强碱 其中B(OHh是两性的氢氧化物,它既溶于酸也溶于碱:
Na2O2 + 2CO2 ─→ Na2CO3 + O2 ↑ KO2 + 2CO2 ─→ 2N2CO3 + 3O2 ↑ 因此,过氧化物和超氧化物常用作防毒面具、高空飞行、潜水的供氧剂。 9-3-3 臭氧化物和*低氧化物 在低温下通过 O3与粉末状无水碱金属(除 Li 外)氢氧化物反应,并用液氨提 取,即可得到红色的 MO3。固体: 3MOH(s) + 2O3(g) ─→ MO3(s) + MOH·H2O(s) + 1/2O2(g) 室温下,臭氧化物缓慢分解为 MO2和 O2: MO3 ─→ 2MO2 + 1/2O2(g) 臭氧化物与水反应,则生成 MOH 和 O2: 4MO3 + 2H2O ─→ 4MOH + 5O2↑ Rb 和 Cs 除可形成以上氧化物外,还可形成低氧化物,如低温时,Rb 发生 不完全氧化可得到 Rb6O,它在-7.3℃以上时分解为 Rb9O2: 2Rb6O Rb9O2 + 3Rb Cs 可形成一系列低氧化物,如 Cs7O(青铜色)、Cs4O(红紫色)、Cs11O3(紫色 晶体)、Cs3+xO(为非化学计量物质)等。 9-4 氢氧化物 碱金属和碱土金属的氧化物(除 BeO、MgO 外)与水作用,即可得到相应的 氢氧化物,并伴随着释放出大量热: M2O + H2O ─→ 2MOH M2O + H2O ─→ 2M(OH)2 碱金属和碱土金属的氢氧化物均为白色固体,易潮解,在空气中吸收 CO2 生成碳酸盐。由于碱金属氢氧化物对纤维、皮肤有强烈的腐蚀作用,故称为苛性 碱。 9-4-1 碱金属和碱土金属氢氧化物的碱性 碱金属和碱土金属氢氧化物[除 Be(OH)2外]均呈碱性,同族元素氢氧化物的 碱性均随金属元素原子序数的增加而增强: LiOH NaOH KOH RbOH CsOH 中强碱 强碱 强碱 强碱 强碱 Be(OH)2 Mg(OH)2 CaOH)2 Sr(OH)2 Ba(OH)2 两性 中强碱 强碱 强碱 强碱 其中 Be(OH)2是两性的氢氧化物,它既溶于酸也溶于碱: