
第十二章过渡元素 本章重点介绍第一过渡系元素和铜分族、锌分族元素,并适当介绍我国丰产 12-1过渡元素概述 广义的过渡元素是指长式周期表中从ⅢB族到ⅡB的所有元素①。它们在长 式周期表中位于s区元素和p区元素之间,因而称为过渡元素。过渡元素单质都 是金属,共分为四个系列。 ① 关于过渡元素的范围有不同的看法,有人认为过渡元素只包括轨道未填 满电子的元素(即IB~WB族)即不包括IB和ⅡB族。也有人认为不应包括 IⅡB族。 IB IVB VB VIB VIIB IB IIB 周期 钪分族钛分族钒分族铬分族锰分族 第八族 铜分族锌分族 4第一过渡 系) Se Ti Cr Mn Fe Co Ni Cu Zn 5(第二过渡 Ru Rh Rb Zr Nb Mo Tc 系) 铁系 Ag Cd 6(第三过渡 Os Ir Pt La-Lu Hf Ta Re Au Hg 系) 轻铂组 7(第四过渡 Hs Mt Uun Ac-Lr Rf Db Sg Bh Uuu Uub 系) 重细组 12-1-1过渡元素原子的特征 过渡元素原子结构的共同特点是价电子一般依次分布在次外层的轨道上 最外层只有1~2个电子(Pd例外),较易失去,其价层电子构型为(n-1)d1-10sl-2。 与同周期主族元素相比,过渡元素的原子半径一般比较小,过渡元素的原子 半径以及它们随原子序数和周期变化的情况如图13-1所示。在各周期中从左向 右,随着原子序数的增加,原子半径缓慢地缩小,直到铜族前后又稍增大。此外 同族元素从上往下,原子半径增大,但第五、六周期(ⅢB除外)由于镧系收缩 (见第十四章)的原因,几乎抵消了同族元素由上往下周期数增加的影响,使这 两周期的同族元素原子半径十分接近,导致第二和第三过渡系的同族元素在性质 上的差异比第一和第二过渡系相应的元素要小。 12.12佰子华径、离子华径知物系收馆 由表14-1 142可见 钢系元 钢系元素的和离子半径总的趋势是随着 原子序数的增加而逐渐减小,这种现象称为镧系收缩、锕系收缩。下面以镧系元
第十二章 过渡元素 本章重点介绍第一过渡系元素和铜分族、锌分族元素,并适当介绍我国丰产 元素、钼钨等。由于钪分族与镧系元素性质相似,在自然界共生,所以把钪分族 放在第十四章中与镧系元素一起介绍。 12-1 过渡元素概述 广义的过渡元素是指长式周期表中从ⅢB 族到ⅡB 的所有元素①。它们在长 式周期表中位于 s 区元素和 p 区元素之间,因而称为过渡元素。过渡元素单质都 是金属,共分为四个系列。 ① 关于过渡元素的范围有不同的看法,有人认为过渡元素只包括轨道未填 满电子的元素(即ⅢB~ⅦB族)即不包括ⅠB 和ⅡB族。也有人认为不应包括 ⅡB族。 \ \ 族 \ 周期 \ \ ⅢB 钪分族 ⅣB 钛分族 ⅤB 钒分族 ⅥB 铬分族 ⅦB 锰分族 Ⅷ 第八族 ⅠB 铜分族 ⅡB 锌分族 4(第一过渡 系) Sc Ti V Cr Mn Fe Co Ni Cu Zn 5(第二过渡 系) Y Zr Nb Mo Tc Ru Rh Rb 铁 系 Ag Cd 6(第三过渡 系) La-Lu Hf Ta W Re Os Ir Pt 轻铂组 Au Hg 7(第四过渡 系) Ac-Lr Rf Db Sg Bh Hs Mt Uun 重铂组 Uuu Uub 12-1-1 过渡元素原子的特征 过渡元素原子结构的共同特点是价电子一般依次分布在次外层的 d 轨道上, 最外层只有 1~2 个电子(Pd 例外),较易失去,其价层电子构型为(n-1)d1-10ns1-2。 与同周期主族元素相比,过渡元素的原子半径一般比较小,过渡元素的原子 半径以及它们随原子序数和周期变化的情况如图 13-1 所示。在各周期中从左向 右,随着原子序数的增加,原子半径缓慢地缩小,直到铜族前后又稍增大。此外, 同族元素从上往下,原子半径增大,但第五、六周期(ⅢB除外)由于镧系收缩 (见第十四章)的原因,几乎抵消了同族元素由上往下周期数增加的影响,使这 两周期的同族元素原子半径十分接近,导致第二和第三过渡系的同族元素在性质 上的差异比第一和第二过渡系相应的元素要小。 12-1-2 原子半径、离子半径和镧系收缩 由表 14-1、14-2 可见,镧系元素、锕系元素的和离子半径总的趋势是随着 原子序数的增加而逐渐减小,这种现象称为镧系收缩、锕系收缩。下面以镧系元

素为例说明。 1.原子半径 在镧系元素的原子中,电子逐个填充4f亚层,由于f电子对原子核的屏蔽 效应较大,所以随着原子序数的增加,有效核电荷缓慢增大,结果使原子半径缓 慢缩小。但从图14-2可以看到,在总的收缩趋势中,Eu和Yb原子半径比较大。 原因是Eu和Yb分别具有半充满(4)和全充满(44)电子层结构,这一相对稳定 结构对核电荷的屏蔽增强,它们的原子半径便明显增大 镧系元素 子半径在Eu和 b处出现骤升的峰值(图142) 与其相对应的 是镧系元素的熔点随着原子序数的增加逐渐升高的过程中,在Eu和Yb处出现 陡降的谷值[图143(a小:Eu(4f)和Yb(4f)为稳定构型,镧系元素原子第 三电离能总和,随着原子序数的增加而增大的过程中,在Eu,Yb处出现骤升的 峰值(图14-3b),就像出现两个山峰或山谷一样,这种现象叫做镧系元素性质递 变的 “双峰效应 2.离子半径 Ln*半径在86~103pm之间,与其它氧化值相同的金属离子相比是比较大的 (A+为53.5pm,Cr3+为61.5pm,Fe3+为64.5pm:Co3为63pm),与原子半径由 La到Lu在Eu、Yb处会出现峰的变化有所不同,Ln*半径的变化是十分有规律 的,如图144所示。Ln*己无6s和5d电子,最外层皆为5s25p结构,La到 L有效核电荷依 增加比 中显著:从La到L心 总共收缩17pm。Ln 带电荷相同,而且Ln3的构型及半径相差不大,致使Ln”性质极为相似:其离 子化合物的溶解度、氢氧化物的酸碱性、配合物的稳定常数,离子晶体的品格能 等彼此都很接近,造成L间分离上的困难。 3期系收缩的后里 系收缩 钢系收缩是元素化学中的一个重要现象。受镧系收缩的影响 方面铕以后的镧系元素的离子半径接近钇,构成性质极为相似的一组元素,称为 钇组元素,它们在自然界中共生,性质十分相似,难于分离:另一方面,第三过 渡系与第二过渡系的同族元素在原子半径(或离子半径)上相近,其中尤以ⅣB族 中的Zr和Hf、VB族中的Nb和Ta、VIB族中的Mo和W更为相近,以致Zr 和Hf、Nb和Ta、Mo和W的性质非常相似, 分离十分闲难 121-2单质的物理性质 过渡金属外观多呈银白色或灰白色,有光泽。除钪和钛属轻金属外,其余均 属重金属,其中以重铂组元素最重,饿、铱、铂的密度依次为22.61、22.65、 21.45gcm3。 多数过渡金属(ⅡB族元素除外)的熔点、沸点高,硬度大。熔点、沸点最 高的是钨(熔点3410C 沸点566 硬度最大的是铬(仅次于金刚石) 究其原因,一般认为是过渡元素的原子半径较小而彼此堆积很紧密,同时金属原 子间除了主要以金屈键结合外,还可能有部分共价性,这与金属原子中未成对 的(n1)d电子也参与成键有关。 12.13会属活滑性 过渡金属在水溶液中的活泼性,可根据标准电极电势(E)来判断
素为例说明。 1. 原子半径 在镧系元素的原子中,电子逐个填充 4f 亚层,由于 f 电子对原子核的屏蔽 效应较大,所以随着原子序数的增加,有效核电荷缓慢增大,结果使原子半径缓 慢缩小。但从图 14-2 可以看到,在总的收缩趋势中,Eu 和 Yb 原子半径比较大。 原因是 Eu 和 Yb 分别具有半充满(4f7 )和全充满(4f14)电子层结构,这一相对稳定 结构对核电荷的屏蔽增强,它们的原子半径便明显增大。 镧系元素的原子半径在 Eu 和 Yb 处出现骤升的峰值(图 14-2),与其相对应的 是镧系元素的熔点随着原子序数的增加逐渐升高的过程中,在 Eu 和 Yb 处出现 陡降的谷值[图 14-3(a)];Eu(4f7 )和 Yb(4f14)为稳定构型,镧系元素原子第一、二、 三电离能总和,随着原子序数的增加而增大的过程中,在 Eu,Yb 处出现骤升的 峰值(图 14-3(b)),就像出现两个山峰或山谷一样,这种现象叫做镧系元素性质递 变的“双峰效应”。 2. 离子半径 Ln3+半径在 86~103pm 之间,与其它氧化值相同的金属离子相比是比较大的 (Al3+为 53.5pm,Cr3+为 61.5 pm,Fe3+为 64.5 pm;Co 3+为 63pm),与原子半径由 La 到 Lu 在 Eu、Yb 处会出现峰的变化有所不同,Ln3+半径的变化是十分有规律 的,如图 14— 4 所示。Ln3+已无 6s 和 5d 电子,最外层皆为 5s2 5p6结构,La 到 Lu 有效核电荷依次增加比在原子中显著;从 La3+到 Lu3+总共收缩 17pm。Ln3+所 带电荷相同,而且 Ln3+的构型及半径相差不大,致使 Ln3+ 性质极为相似:其离 子化合物的溶解度、氢氧化物的酸碱性、配合物的稳定常数,离子晶体的晶格能 等彼此都很接近,造成 Ln3+间分离上的困难。 3. 镧系收缩的后果 镧系收缩、锕系收缩是元素化学中的一个重要现象。受镧系收缩的影响,一 方面铕以后的镧系元素的离子半径接近钇,构成性质极为相似的一组元素,称为 钇组元素,它们在自然界中共生,性质十分相似,难于分离;另一方面,第三过 渡系与第二过渡系的同族元素在原子半径(或离子半径)上相近,其中尤以ⅣB 族 中的 Zr 和 Hf、VB 族中的 Nb 和 Ta、ⅥB 族中的 Mo 和 W 更为相近,以致 Zr 和 Hf、Nb 和 Ta、Mo 和 W 的性质非常相似,分离十分困难。 12-1-2 单质的物理性质 过渡金属外观多呈银白色或灰白色,有光泽。除钪和钛属轻金属外,其余均 属重金属,其中以重铂组元素最重,锇、铱、铂的密度依次为 22.61、22.65、 21.45g·cm-3。 多数过渡金属(ⅡB 族元素除外)的熔点、沸点高,硬度大。熔点、沸点最 高的是钨(熔点 3410℃,沸点 5660℃),硬度最大的是铬(仅次于金刚石)。 究其原因,一般认为是过渡元素的原子半径较小而彼此堆积很紧密,同时金属原 子间除了主要以金属键结合外,还可能有部分共价性 ,这与金属原子中未成对 的(n-1)d 电子也参与成键有关。 12-1-3 金属活泼性 过渡金属在水溶液中的活泼性,可根据标准电极电势(E Ө)来判断
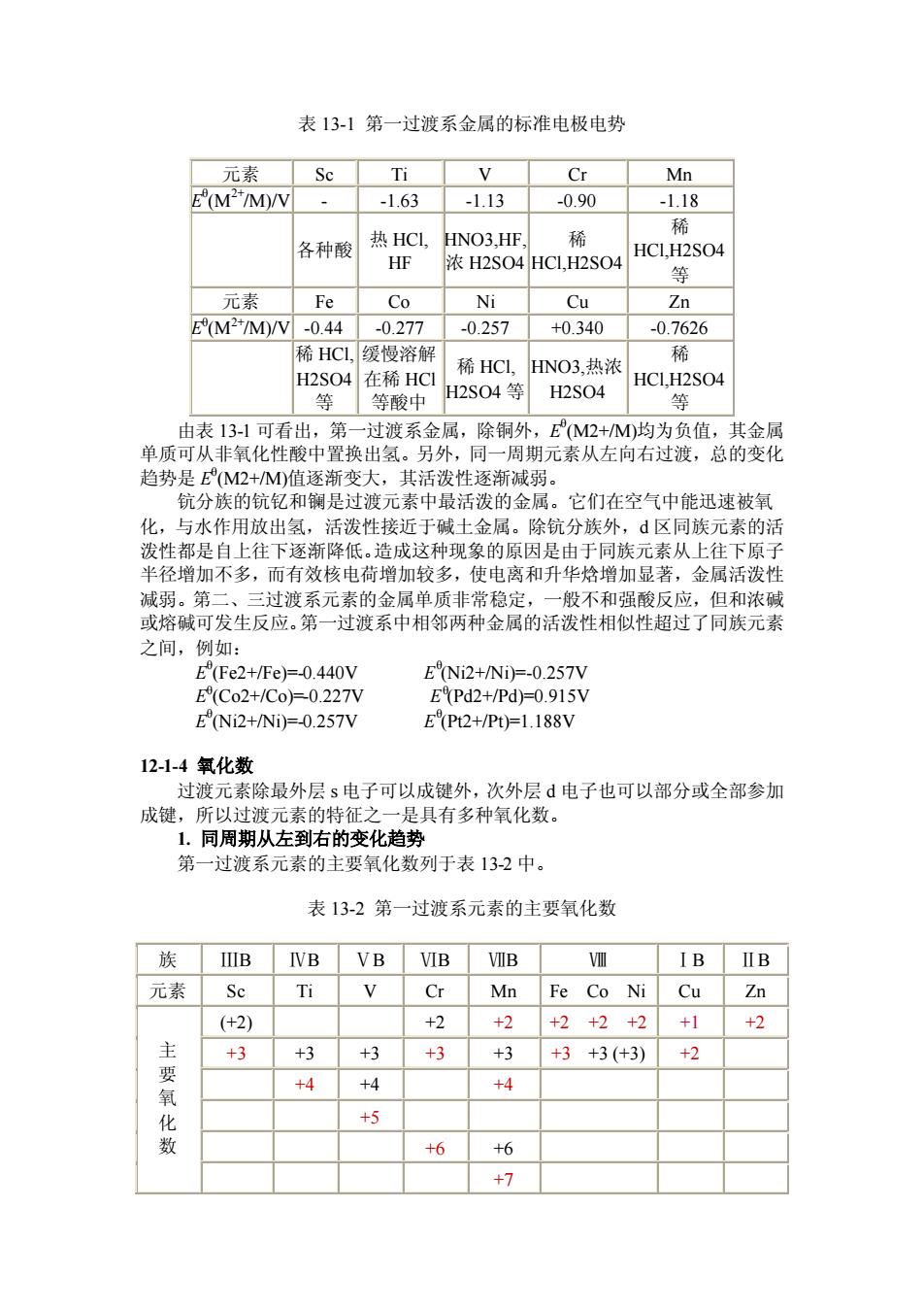
表13-1第一过渡系金属的标准电极电势 元素 Se Ti Mn E(MM/V -1.63 -113 -0.90 -118 各种酸 热HC 浓H2S04HC1H2S04 等 元素 Fe Co Ni Cu Zn M2*M/W-0.44-0.277 -0.257 +0.340 -0.7626 稀HC1缓慢容解 希HCL HNO3执浓 H2SO4在稀HC1 HCLH2S04 H2S04等 H2S04 等酸中 由表131可看出,第 过渡系金属,除铜外 E(M2 +M均为负值, 其金 单质可从非氧化性酸中置换出氢。另外,同一周期元素从左向右过渡,总的变化 趋势是M2+M值逐渐变大,其活泼性逐渐减弱。 钪分族的钪钇和镧是过波元素中最活泼的金属。它们在空气中能迅速被氧 化,与水作用放出氢,活泼性接近于碱土金属。除钪分族外,d区同族元素的活 性都是自上往 下逐渐 造成这种现象的原因是由 素从上往 径增加不多,而有效核电荷增加较多,使电离和升华焓增加显著,金属活泼 减弱。第二、三过渡系元素的金属单质非常稳定,一般不和强酸反应,但和浓碱 或熔碱可发生反应。第一过渡系中相邻两种金属的活泼性相似性超过了同族元素 之间,例如: EFe2+/Fe)=0.440 E(Co2+/Co0.227八 ENi2+/Ni)=0.257V E(Pt2+/Pt)=1.188V 12-1-4氧化数 过渡元素除最外层s电子可以成键外,次外层电子也可以部分或全部参加 成键,所以过渡元素的特征之一是具有多种氧化数】 1.同周期从左到右的变化趋势 第一过渡系元素的主要氧化数列于表132中。 表13-2第一过渡系元素的主要氧化数 族UIB IVB VB VIB VIB 元素Sc Ti V Cr Mn Fe Co Ni Cu Zn (+2) +2 +2+2+2+2+1 +2 主要氧 +3 +3 +3 +3 +3 +3+3(+3) +2 +4 +4 +5 6 +6 +7
表 13-1 第一过渡系金属的标准电极电势 元素 Sc Ti V Cr Mn E θ (M2+/M)/V - -1.63 -1.13 -0.90 -1.18 各种酸 热 HCl, HF HNO3,HF, 浓 H2SO4 稀 HCl,H2SO4 稀 HCl,H2SO4 等 元素 Fe Co Ni Cu Zn E θ (M2+/M)/V -0.44 -0.277 -0.257 +0.340 -0.7626 稀 HCl, H2SO4 等 缓慢溶解 在稀 HCl 等酸中 稀 HCl, H2SO4 等 HNO3,热浓 H2SO4 稀 HCl,H2SO4 等 由表 13-1 可看出,第一过渡系金属,除铜外,E θ (M2+/M)均为负值,其金属 单质可从非氧化性酸中置换出氢。另外,同一周期元素从左向右过渡,总的变化 趋势是 E θ (M2+/M)值逐渐变大,其活泼性逐渐减弱。 钪分族的钪钇和镧是过渡元素中最活泼的金属。它们在空气中能迅速被氧 化,与水作用放出氢,活泼性接近于碱土金属。除钪分族外,d 区同族元素的活 泼性都是自上往下逐渐降低。造成这种现象的原因是由于同族元素从上往下原子 半径增加不多,而有效核电荷增加较多,使电离和升华焓增加显著,金属活泼性 减弱。第二、三过渡系元素的金属单质非常稳定,一般不和强酸反应,但和浓碱 或熔碱可发生反应。第一过渡系中相邻两种金属的活泼性相似性超过了同族元素 之间,例如: E θ (Fe2+/Fe)=-0.440V E θ (Ni2+/Ni)=-0.257V E θ (Co2+/Co)=-0.227V E θ (Pd2+/Pd)=0.915V E θ (Ni2+/Ni)=-0.257V E θ (Pt2+/Pt)=1.188V 12-1-4 氧化数 过渡元素除最外层 s 电子可以成键外,次外层 d 电子也可以部分或全部参加 成键,所以过渡元素的特征之一是具有多种氧化数。 1. 同周期从左到右的变化趋势 第一过渡系元素的主要氧化数列于表 13-2 中。 表 13-2 第一过渡系元素的主要氧化数 族 ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB 元素 Sc Ti V Cr Mn Fe Co Ni Cu Zn (+2) - - +2 +2 +2 +2 +2 +1 +2 +3 +3 +3 +3 +3 +3 +3 (+3) +2 - - +4 +4 - +4 - - - - - +5 - - - - - - - - +6 +6 - - - 主 要 氧 化 数 - - - - +7 - - -

表中红色字氧化数是稳定的氧化数,有括号的表示不稳定的氧化数。由表 13-2可见从左向右,随原子序数增加(21S -2s Mn) 元素最高氧化数逐渐增高, 但当3d轨道中电子数超过5时,元素最高氧化数又转向降低6一→2N,最后 与IB族元素的低氧化数相衔接。 图132中的弗洛斯特图可清楚的说明第一过渡系金属各氧化态的热力学稳 定性的变化趋势。 2.同族从上往下的变化趋势 铬分族VB)的弗洛斯特图见图133。 由表13-2及图13-3可以看出:(1)过 渡元素相邻两个氧化态的氧化数间的差值为1或2,而p区元素常为2。(2)ⅢB VⅦB族元素(个别镧系元素除外)的最高氧化态的氧化数与族号相等,但Ⅷ族元素 大多达不到+8。Sc、Ti族IIB一几VB)的高氧化态比较稳定。第一过度系的VB IB族元素最高氧化态的化合物不稳定:而第二、三过波系的高氧化态比较稳定, 即从上往下趋向于形成高氧化态化合物,这与p区ⅢA、NA、VA族元素恰好 相反 此外,许多过渡元素还能形成氧化数为0,1,-2,3的化合物,例如: 配合物 [Ni(CO)4] [Co(Co[Cr(Co为 [Mn(CO)]3 形成体氧化 0 -2 12-1-5非整比化合物 过渡元素的另 一个特点是易形成非整比(或称非化学计量)化合物。非整比 个较小的范围内变 寺基本结构不变。 例 O按立方密堆积排列,而Fe”在八面体空穴内,当Fe未占满所有空穴时,为 了保持电中性,在附近的空穴上由两个Fe+所占据(见图13-4)。 近年来发现非整比化合物有多方面的用途,例如作为固体电解质(ZO2】 12-1-6化合物的颜色 过渡元素的另一特征是它们所形成的配离子大都显色,这主要与过渡元素离 子的d轨道未填满电子有关。第一过渡系元素低氧化数水合离子的颜色如表13-3 所示。 表133第一过渡系元素的氧化数水合离子的颜色 元素 Sc Ti V Cr Mn Fe Co Ni Cu Zn M*中d电子数 234 5 6 789 10 MH,O2+颜· 褐紫天蓝浅桃红(儿浅绿粉红绿浅蓝无色
表中红色字氧化数是稳定的氧化数,有括号的表示不稳定的氧化数。由表 13-2 可见从左向右,随原子序数增加(21Sc→25Mn),元素最高氧化数逐渐增高, 但当 3d 轨道中电子数超过 5 时,元素最高氧化数又转向降低(26Fe→ 28Ni),最后 与ⅠB族元素的低氧化数相衔接。 图 13-2 中的弗洛斯特图可清楚的说明第一过渡系金属各氧化态的热力学稳 定性的变化趋势。 2. 同族从上往下的变化趋势 铬分族( B) Ⅵ 的弗洛斯特图见图 13-3。由表 13-2 及图 13-3 可以看出:(1)过 渡元素相邻两个氧化态的氧化数间的差值为 1 或 2,而 p 区元素常为 2。(2) B Ⅲ ~ ⅦB族元素(个别镧系元素除外)的最高氧化态的氧化数与族号相等,但Ⅷ族元素 大多达不到+8。Sc、Ti 族( B Ⅲ ~ⅣB)的高氧化态比较稳定。第一过渡系的ⅤB~ ⅦB族元素最高氧化态的化合物不稳定;而第二、三过渡系的高氧化态比较稳定, 即从上往下趋向于形成高氧化态化合物,这与 p 区ⅢA、ⅣA、ⅤA 族元素恰好 相反。 此外,许多过渡元素还能形成氧化数为 0,-1,-2,-3 的化合物,例如: 配合物 [Ni(CO)4] [Co(CO)4] - [Cr(CO)5] 2- [Mn(CO)4] 3- 形成体氧化 数 0 -1 -2 -3 12-1-5 非整比化合物 过渡元素的另一个特点是易形成非整比(或称非化学计量)化合物。非整比化 合物的化学组成不定,可在一个较小的范围内变动,而又保持基本结构不变。例 如 1000℃时 FeO 的组成实际在 Fe0.89O 到 Fe0.96O 之间变动。在 FeO 晶体中, O 2-按立方密堆积排列,而 Fe2+在八面体空穴内,当 Fe2+未占满所有空穴时,为 了保持电中性,在附近的空穴上由两个 Fe3+所占据(见图 13-4)。 近年来发现非整比化合物有多方面的用途,例如作为固体电解质(ZrO2, HfO2)用于各类化学电源和电化学器件中;还用作半导体(ZnO,Cu2O)以及超导体 (YBaCu3O7-x,x≤0.1)材料等。 12-1-6 化合物的颜色 过渡元素的另一特征是它们所形成的配离子大都显色,这主要与过渡元素离 子的 d 轨道未填满电子有关。第一过渡系元素低氧化数水合离子的颜色如表 13-3 所示。 表 13-3 第一过渡系元素的氧化数水合离子的颜色 元素 Sc Ti V Cr Mn Fe Co Ni Cu Zn M 2+中 d 电子数 - 2 3 4 5 6 7 8 9 10 [M(H2O)6] 2+ 颜 - 褐 紫 天蓝 浅桃红(几 浅绿 粉红 绿 浅蓝 无色

色 乎无色) M+中d电子数0 123 4 [MHO)颜色无紫绿蓝紫红浅紫绿粉红 同一中心离子与不同配体形成配合物时,由于品体场分裂能不同,则d一d 跃迁时所需能量也不同,亦即吸收光的波长不同,因此显不同的颜色。例如: [Ni0H,O62+ [Ni(NH3)12 d-d跃迁时吸收光的波长(O/nm 1176 925 配离子的颜色 果绿 蓝 由表13-3可以看出,d°和d°构型的中心离子形成的配合物,在可见光照射 下不发生d-d跃迁,如[Sc(HO)6(d、[Zn(H2O)62*(d)均为无色。 元 最 氧化态 电荷分别为M Vs+ 均为 电子构型,似也应为无色,之所以呈颜色是由电荷迁移引起的,例如MO:的紫 色是由于02→Mn电子跃迁(p-d跃迁)的吸收峰在可见光区18500cm处。 12-1-7配合性和催化性 过渡元素容易形成配合物。通常认为:过渡元素的原子或离子具有能级相近 的价层电子轨道n-1)d、 s和 其中s和p轨道是空的,(m1)d轨道是部分 本的孤电子对:而且过渡元素的 般具有较高的电荷和 不的半径极化力强,对配休有较强的吸引力。因此,进波元素具有根强的蜀 配合物的倾向。 许多过度元素及其化合物具有独特的催化性能。例如,在反应过程中,过渡 元素可形成不稳定的配合物,这些配合物作为中间产物可起到配位催化作用:又 如过渡元素也可通过提供适宜的反应表面,起到接触催化作用,以V0为触媒 制五SO4即为一例。 12-1-8磁性 多数过渡元素的原子或离子有未成对的电子,所以具有顺磁性。未成对的d 电子越多,磁矩4也越大(如表13-4所示)。 表13-4未成对d电子数与物质磁性的关系 离子V02+v+Cr*Mm㎡2+Fe2+Co2+N2*Cu2+ d电子数12356789
色 乎无色) M 3+中 d 电子数 0 1 2 3 4 5 6 7 [M(H2O)6] 3+颜色 无 紫 绿 蓝紫 红 浅紫 绿 粉红 同一中心离子与不同配体形成配合物时, 由于晶体场分裂能不同,则 d— d 跃迁时所需能量也不同,亦即吸收光的波长不同,因此显不同的颜色。例如: [Ni(H2O)6] 2+ [Ni(NH3)6] 2+ d-d 跃迁时吸收光的波长(λ)/nm 1176 925 配离子的颜色 果绿 蓝 由表 13-3 可以看出,d 0和 d 10 构型的中心离子形成的配合物,在可见光照射 下不发生 d-d 跃迁, 如 [Sc(H2O)6] 3+(d0 )、[Zn(H2O)6] 2+(d10)均为无色。 对于某些含氧酸根离子如 MnO4 - (紫色)、CrO4 2- (黄色)、VO4 3- (淡黄色),它们 中的金属元素均处于最高氧化态,其形式电荷分别为 Mn7+、Cr6+、V 5+,均为 d 0 电子构型,似也应为无色,之所以呈颜色是由电荷迁移引起的,例如 MnO4 -的紫 色是由于 O 2-→ Mn 7+电子跃迁(p-d 跃迁)的吸收峰在可见光区 18500cm-1处。 12-1-7 配合性和催化性 过渡元素容易形成配合物。通常认为:过渡元素的原子或离子具有能级相近 的价层电子轨道(n-1)d、ns 和 np,其中 ns 和 np 轨道是空的,(n-1)d 轨道是部分 空的,可以接受配体的孤电子对;而且过渡元素的离子一般具有较高的电荷和较 小的半径,极化力强,对配体有较强的吸引力。因此,过渡元素具有很强的形成 配合物的倾向。 许多过渡元素及其化合物具有独特的催化性能。例如,在反应过程中,过渡 元素可形成不稳定的配合物,这些配合物作为中间产物可起到配位催化作用;又 如过渡元素也可通过提供适宜的反应表面,起到接触催化作用, 以 V2O5为触媒 制 H2SO4 即为一例。 12-1-8 磁性 多数过渡元素的原子或离子有未成对的电子,所以具有顺磁性。未成对的 d 电子越多,磁矩 μ也越大(如表 13-4 所示)。 表 13-4 未成对 d 电子数与物质磁性的关系 离子 VO2+ V 3+ Cr3+ Mn2+ Fe2+ Co2+ Ni2+ Cu2+ d 电子数 1 2 3 5 6 7 8 9