
第五章配位滴定法 §5一1慨述 配位滴定法是以配位反应为基础的一种滴定分析方法。早期,用AgNO,标准溶液滴定 CN,发生如下反应: Ag*+2CN[Ag(CN)z] 滴定到达化学计量点时,多加一滴AgNO3溶液,Ag就与[Ag(CN)2]ˉ反应生成白 色的Ag[Ag(CN)Σ]沉淀,以指示终点的到达。终点时的反应为 [Ag(CN)2]-+Ag'-Ag[Ag(CN)2] 配合物(complex)的稳定性以配合物稳定常数K稳表示,如上例中 Ke-TAg ICN10 [Ag(CN) [Ag(CN)2]的K®=102,说明反应进行得完全。各种配合物都有其一定的稳定常数, 从配合物稳定常数的大小可以判断配位反应的完全程度以及能否满足滴定分析的要求。 配位滴定中常用的滴定剂即配位剂(complexing agent)有二类: 一类是无机配位剂 另一类是有机配位剂. 一般无机配位剂很少用于滴定分析,这是因为①这类配位剂和金属离 子形成的配合物不够稳定,不能符合滴定反应的要求:②在配位过程中有逐级配位现象,而 且各级配合物的稳定常数相差较小,故溶液中常常同时存在多种形式的配位离子(简称配离 子),使滴定过程中突跃不明显,终点难以判断,而且也无恒定的化学计量关系。例如C 与CN~的配位反应分四级进行,存在下列四种形式: C++CN一[CdCN)]'一CdCN)2[Cd(CN)3]一[Cd(CN). K83.02×10 1.38×1033.63×105 3.80×10 因为各级稳定常数相差很小,因而滴定时产物的组成不定,化学计最关系也不恒定。 所以无机配位剂在分析化学中的应用受到一定的限制。大多数有机配位剂与金属离子的配位 反应不存在上述的缺陷,故配位滴定中常用有机配位剂,其中最常用的是氨梭类配位剂。 氨竣配位剂大部分是以氨基二乙酸基团[一N(CH,COOH)为基体的有机配位剂(或 0 称螫合剂(chelant),这类配位剂中含有配位能力很强的氨氮 和羧氧 例如,铜及铜合金中的A1(GB512104一1996)和水处理剂A1C1(GB15892一1995) 测定都是在试液中加人过量的EDTA,使与AI配位完全,用Z溶液去除过量的EDTA, 然后加NaF或KF,置换出与AI配位的EDTA,再以Zn标准溶液滴定之。 又如,测定锡合金中的Sn时 ,也是采用类似的方式 ,于试液中加人过量的EDTA 可能存在的如Pb、Zn、Cd2、Bi等与Sn"一起发生配位反应。用Zn2标准溶液除去过 量的EDTA。加人N4F,使与SnY中的Sn“发生配位反应,并将EDTA释放置换出米,再 用Z2标准溶液滴定释放出的EDTA,即可求得S"的含量。 置换滴定法是提高配位滴定选择性的途径之一,同时也扩大了配位滴定的应用范围
第五章 配位滴定法 §5—1 慨述 配位滴定法是以配位反应为基础的一种滴定分析方法。早期,用 AgNO3标准溶液滴定 CN,发生如下反应: 滴定到达化学计量点时,多加一滴 AgNO3 溶液,Ag+就与[Ag(CN)2] -反应生成白 色的 Ag[Ag(CN)2]沉淀,以指示终点的到达。终点时的反应为 配合物(complex)的稳定性以配合物稳定常数 K 稳表示,如上例中: [Ag(CN)2]-的 K 稳=1021.l,说明反应进行得完全。各种配合物都有其一定的稳定常数, 从配合物稳定常数的大小可以判断配位反应的完全程度以及能否满足滴定分析的要求。 配位滴定中常用的滴定剂即配位剂(complexing agent)有二类:一类是无机配位剂, 另一类是有机配位剂。一般无机配位剂很少用于滴定分析,这是因为①这类配位剂和金属离 子形成的配合物不够稳定,不能符合滴定反应的要求;②在配位过程中有逐级配位现象,而 且各级配合物的稳定常数相差较小,故溶液中常常同时存在多种形式的配位离子(简称配离 子),使滴定过程中突跃不明显,终点难以判断,而且也无恒定的化学计量关系。例如 Cd2+ 与 CN-的配位反应分四级进行,存在下列四种形式: 因为各级稳定常数相差很小,因而滴定时产物的组成不定,化学计量关系也不恒定。 所以无机配位剂在分析化学中的应用受到一定的限制。大多数有机配位剂与金属离子的配位 反应不存在上述的缺陷,故配位滴定中常用有机配位剂,其中最常用的是氨梭类配位剂。 氨竣配位剂大部分是以氨基二乙酸基团[-N(CH2COOH)2]为基体的有机配位剂(或 称螫合剂(chelant)),这类配位剂中含有配位能力很强的氨氮 和羧氧 这两种配位原子,它们能与多种金属离子形成 的含量。 例如,铜及铜合金中的 Al(GB 512104 一 1996)和水处理剂 AlCl3(GB15892—1995) 测定都是在试液中加人过量的 EDTA,使与 AI 配位完全,用 Zn2+溶液去除过量的 EDTA, 然后加 NaF 或 KF,置换出与 AI 配位的 EDTA,再以 Zn2+标准溶液滴定之。 又如,测定锡合金中的 Sn 时,也是采用类似的方式,于试液中加人过量的 EDTA,将 可能存在的如 Pb2+、Zn2+、Cd2+、Bi3+等与 Sn Ⅳ一起发生配位反应。用 Zn2+标准溶液除去过 量的 EDTA。加人 N4F,使与 SnY 中的 Sn Ⅳ发生配位反应,并将 EDTA 释放置换出来,再 用 Zn2+标准溶液滴定释放出的 EDTA,即可求得 Sn Ⅳ的含量。 置换滴定法是提高配位滴定选择性的途径之一,同时也扩大了配位滴定的应用范围

再如,铬黑T与Ca+显色的灵敏度较差,但与Mg+显色却很灵敏,为此,在pH10 的溶液中,用EDTA滴定Ca2时,常于溶液中先加人少量MgY,由于Ig KcaY=10.69,g Mey=8.69,此时发生下列置换反应 MgY Ca2" CaY Mg? 置换出来的Mg与铬黑T的配合物显很深的红色。滴定时,EDTA先与Ca配位(请读 者思考一下,为什么?),到滴定终点时,EDTA夺取Mg一铬黑T配合。物中的Mg, 游离出蓝色的指示剂,颜色变化很明显。此处,滴定前加人的少量MgY与最后生成的MgY 的量相等,故加人的MgY不影响测定结果。这是通过置换滴定, 提高指示剂指示终点敏 锐性的例子 用CY一PAN作指示剂时,也是利用置换滴定法的原理。 间接滴定对于不能形成配合物或者形成的配合物不稳定的情况可采用间接滴定。 此法是加人过量的、能与EDTA形成稳定配合物的金属高子作沉淀剂,以沉淀待测离子 过量沉淀剂用EDTA滴定。或将沉淀分高、溶解后,再用EDTA滴定其中的金属离子。例 如测定PO- 可加一定量过量的Bi(NO,),使之生成BPO4沉淀,再用EDTA滴 剩余的Bi,又如测定Na时,将Na沉淀为醋酸鈾酚锌钠NaOAc·Zn(OAc)2·3UO: (OAc)2·9H,0,分离沉淀,溶解后,用EDTA滴定Zn2,从而求得Na含量。 间接滴定方式操作较繁,当然,引人误差的机会也增多,不是一种很好的分析测定的 方法 第五章配位滴定法 §5—1慨述 配位滴定法是以配位反应为基础的一种滴定分析方法。早期,用AgNO,标准溶液滴定 CN,发生如下反应: Ag+2CN[Ag(CN)2] 滴定到达化学计量点时,多加一滴AgNO,溶液,Ag就与[Ag(CN)2]ˉ反应生成白 色的Ag[Ag(CN)]沉淀,以指示终点的到达。终点时的反应为 [Ag(CN)2]-+Ag'=Ag[Ag(CN)2] 配合物(complex)的稳定性以配合物稳定常数K稳表示,如上例中: K。=eC5=10 [Ag(CN)]的K=102山,说明反应进行得完全。各种配合物都有其一定的稳定常数 从配合物稳定常数的大小可以判新配位反应的完全程度以及能否满足滴定分析的要求 配位滴定中常用的滴定剂即配位剂(complexing agent)有二类:一类是无机配位剂, 另一类是有机配位剂。一般无机配位剂很少用于滴定分析,这是因为①这类配位剂和金属离 子形成的配合物不够稳定,不能符合滴定反应的要求:②在配位过程中有逐级配位现象 且各级配合物的稳定常数相差较小,故溶液中常常同时存在多种形式 位离子(简称配 子),使滴定过程中突跃不明显,终点难以判断,而且也无恒定的化学计量关系。例如Cd 与CN的配位反应分四级进行,存在下列四种形式:
再如,铬黑 T 与 Ca2+显色的灵敏度较差,但与 Mg2+显色却很灵敏,为此,在 pH=10 的溶液中,用 EDTA 滴定 Ca2+时,常于溶液中先加人少量 MgY,由于 Ig KCaY= 10.69,lg KMgY=8.69,此时发生下列置换反应: 置换出来的 Mg2+与铬黑 T 的配合物显很深的红色。滴定时,EDTA 先与 Ca2+配位(请读 者思考一下,为什么?),到滴定终点时,EDTA 夺取 Mg-铬黑 T 配合。物中的 Mg2+, 游离出蓝色的指示剂,颜色变化很明显。此处,滴定前加人的少量 MgY 与最后生成的 MgY 的量相等,故加人的 MgY 不影响测定结果。这是通过置换滴定,提高指示剂指示终点敏 锐性的例子。 用 CuY 一 PAN 作指示剂时,也是利用置换滴定法的原理。 间接滴定 对于不能形成配合物或者形成的配合物不稳定的情况可采用间接滴定。 此法是加人过量的、能与 EDTA 形成稳定配合物的金属离子作沉淀剂,以沉淀待测离子, 过量沉淀剂用 EDTA 滴定。或将沉淀分离、溶解后,再用 EDTA 滴定其中的金属离子。例 如测定 PO4 3-,可加一定量过量的 Bi(NO3)3,使之生成 BiPO4 沉淀,再用 EDTA 滴定 剩余的 Bi3+。又如测定 Na+时,将 Na+沉淀为醋酸铀酚锌钠 NaOAc·Zn(OAc)2·3UO2 (OAc)2·9H2O,分离沉淀,溶解后,用 EDTA 滴定 Zn2+,从而求得 Na+含量。 间接滴定方式操作较繁,当然,引人误差的机会也增多,不是一种很好的分析测定的 方法. 第五章 配位滴定法 §5—1 慨述 配位滴定法是以配位反应为基础的一种滴定分析方法。早期,用 AgNO3标准溶液滴定 CN,发生如下反应: 滴定到达化学计量点时,多加一滴 AgNO3 溶液,Ag+就与[Ag(CN)2] -反应生成白 色的 Ag[Ag(CN)2]沉淀,以指示终点的到达。终点时的反应为 配合物(complex)的稳定性以配合物稳定常数 K 稳表示,如上例中: [Ag(CN)2]-的 K 稳=1021.l,说明反应进行得完全。各种配合物都有其一定的稳定常数, 从配合物稳定常数的大小可以判断配位反应的完全程度以及能否满足滴定分析的要求。 配位滴定中常用的滴定剂即配位剂(complexing agent)有二类:一类是无机配位剂, 另一类是有机配位剂。一般无机配位剂很少用于滴定分析,这是因为①这类配位剂和金属离 子形成的配合物不够稳定,不能符合滴定反应的要求;②在配位过程中有逐级配位现象,而 且各级配合物的稳定常数相差较小,故溶液中常常同时存在多种形式的配位离子(简称配离 子),使滴定过程中突跃不明显,终点难以判断,而且也无恒定的化学计量关系。例如 Cd2+ 与 CN-的配位反应分四级进行,存在下列四种形式:

Cd++CN-[Cd(CN)]*=Cd(CN)2=[Cd(CN)3]-[Cd(CN) K3.02×103 1.38×10 3.63×105 3.80×103 因为各级稳定常数相差很小,因而滴定时产物的组成不定,化学计量关系也不恒定。 所以无机配位剂在分析化学中的应用受到一定的限制。大多数有机配位剂与金属离子的配位 反应不存在上述的缺陷,故配位滴定中常用有机配位剂,其中最常用的是氨梭类配位剂。 氨竣配位剂大部分是以氨基二乙酸基团[一N(CHCOOH)]为基体的有机配位剂(或 (N)(C-0-) 0 称螫合剂(chelant)),这类配位剂中含有配位能力很强的氨氨 和羧氧 这两种配位原子,它们能与多种金属离子形成 的含量。 例如,铜及铜合金中的A(GB512104一1996)和水处理剂A1C(GB15892-1995) 测定都是在试液中加人过量的EDTA,使与AI配位完全,用Zn溶液去除过量的EDTA, 然后加NaF或KF,置换出与AI配位的EDTA,再以Zn+标准溶液滴定之. 又如,测定锡合金中的S知时,也是采用类似的方式,于试液中加人过量的EDTA,将 可能存在的如Pb2、Zn2、Cd24、B等与SW一起发生配位反应。用Zn2标准溶液除去过 量的EDTA.加人N4F,使与SY中的Sn发生配位反应,并将EDTA释放置换出来,再 用Zn标准溶液滴定释放出的EDTA,即可求得Sn"的含量。 置换滴定法是提高配位滴定选择性的途径之一,同时也扩大了配位滴定的应用范围。 再如,铬黑T与Ca+显色的灵敏度较差,但与Mg+显色却很灵敏,为此,在p10 的溶液中,用EDTA滴定Ca2时,常于溶液中先加人少量MgY,由于gkCv=10.69,g eY=8.69,此时发生下列置换反应: MgY Ca2 CaY Mg2 置换出来的Mg2与铬黑T的配合物显很深的红色。滴定时,DTA先与Ca配位(请读 者思考一下,为什么?),到滴定终点时,EDTA夺取Mg一铬黑T配合。物中的Mg, 游离出蓝色的指示剂,颜色变化很明显。此处,滴定前加人的少最MgY与最后生成的MgY 的量相等,故加人的MgY不影响测定结果。这是通过置换滴定,提高指示剂指示终点敏 锐性的例 用CuY一PAN作指示剂时,也是利用置换滴定法的原理。 间接滴定对于不能形成配合物或者形成的配合物不稳定的情况可采用间接滴定。 此法是加人过量的、能与EDTA形成稳定配合物的金属离子作沉淀剂,以沉淀待测离子, 过量沉淀剂用EDTA滴定。或将沉淀分离、溶解后,再用EDTA滴定其中的金属离子。例 如测定PO 一定量过量的Bi(NO)3,使之生成 BPO4沉淀,再用EDTA滴 剩余的B。又如测定Na时,将Na沉淀为醋酸铀酚锌钠NaOAc·Zn(OAc),·3UO, (OAc)2·9H,O,分离沉淀,溶解后,用EDTA滴定Zn2,从而求得Na含量。 间接滴定方式操作较繁,当然,引人误差的机会也增多,不是一种很好的分析测定的 方法 第稳定的可溶性配合物。氨骏配位剂的种类很多,常见的有以下几种: 乙H胺四乙酸,简称EDTA:
因为各级稳定常数相差很小,因而滴定时产物的组成不定,化学计量关系也不恒定。 所以无机配位剂在分析化学中的应用受到一定的限制。大多数有机配位剂与金属离子的配位 反应不存在上述的缺陷,故配位滴定中常用有机配位剂,其中最常用的是氨梭类配位剂。 氨竣配位剂大部分是以氨基二乙酸基团[-N(CH2COOH)2]为基体的有机配位剂(或 称螫合剂(chelant)),这类配位剂中含有配位能力很强的氨氮 和羧氧 这两种配位原子,它们能与多种金属离子形成 的含量。 例如,铜及铜合金中的 Al(GB 512104 一 1996)和水处理剂 AlCl3(GB15892—1995) 测定都是在试液中加人过量的 EDTA,使与 AI 配位完全,用 Zn2+溶液去除过量的 EDTA, 然后加 NaF 或 KF,置换出与 AI 配位的 EDTA,再以 Zn2+标准溶液滴定之。 又如,测定锡合金中的 Sn 时,也是采用类似的方式,于试液中加人过量的 EDTA,将 可能存在的如 Pb2+、Zn2+、Cd2+、Bi3+等与 Sn Ⅳ一起发生配位反应。用 Zn2+标准溶液除去过 量的 EDTA。加人 N4F,使与 SnY 中的 Sn Ⅳ发生配位反应,并将 EDTA 释放置换出来,再 用 Zn2+标准溶液滴定释放出的 EDTA,即可求得 Sn Ⅳ的含量。 置换滴定法是提高配位滴定选择性的途径之一,同时也扩大了配位滴定的应用范围。 再如,铬黑 T 与 Ca2+显色的灵敏度较差,但与 Mg2+显色却很灵敏,为此,在 pH=10 的溶液中,用 EDTA 滴定 Ca2+时,常于溶液中先加人少量 MgY,由于 Ig KCaY= 10.69,lg KMgY=8.69,此时发生下列置换反应: 置换出来的 Mg2+与铬黑 T 的配合物显很深的红色。滴定时,EDTA 先与 Ca2+配位(请读 者思考一下,为什么?),到滴定终点时,EDTA 夺取 Mg-铬黑 T 配合。物中的 Mg2+, 游离出蓝色的指示剂,颜色变化很明显。此处,滴定前加人的少量 MgY 与最后生成的 MgY 的量相等,故加人的 MgY 不影响测定结果。这是通过置换滴定,提高指示剂指示终点敏 锐性的例子。 用 CuY 一 PAN 作指示剂时,也是利用置换滴定法的原理。 间接滴定 对于不能形成配合物或者形成的配合物不稳定的情况可采用间接滴定。 此法是加人过量的、能与 EDTA 形成稳定配合物的金属离子作沉淀剂,以沉淀待测离子, 过量沉淀剂用 EDTA 滴定。或将沉淀分离、溶解后,再用 EDTA 滴定其中的金属离子。例 如测定 PO4 3-,可加一定量过量的 Bi(NO3)3,使之生成 BiPO4 沉淀,再用 EDTA 滴定 剩余的 Bi3+。又如测定 Na+时,将 Na+沉淀为醋酸铀酚锌钠 NaOAc·Zn(OAc)2·3UO2 (OAc)2·9H2O,分离沉淀,溶解后,用 EDTA 滴定 Zn2+,从而求得 Na+含量。 间接滴定方式操作较繁,当然,引人误差的机会也增多,不是一种很好的分析测定的 方法. 第稳定的可溶性配合物。氨骏配位剂的种类很多,常见的有以下几种: 乙 H 胺四乙酸,简称 EDTA:

HOOCHC CH2COOH N-CH:-CH2-N HOOCHC CHCOOH 环己烷二胺四乙酸,简称CyDTA: CHCOOH HC CH CHCOOH HC CH-N CH-COOH 乙二醇二乙醚二胺四乙酸(EGTA): CH2COOH CH2-O-CH2-CH2-N CHCOOH CH-COOH CH2-O-CH2-CH2-N CH.COOH 乙二胺四丙酸(EDTP): CH2-N CH2CH.COOH CH2CH2COOH CH,CH,COOH 氨竣配位剂中应用最为广泛的是EDTA,它可以直接滴定或间接滴定几十种金属离子。 本章主要讨论以EDTA为配位剂,滴定金属离子的配位滴定法。 §5一2EDTA与金属离子的配合物及其稳定性 EDTA的性质 乙一胺四乙酸(ethylen diamine tetraacetic acid,EDTA或EDTA酸),它是个多元酸, 可用HY表示, 在水中的溶解度很小(22℃时,100 m水中仅能溶解0. 02g),也 难溶于酸和 氨溶液和苛性碱溶液中 生成 相 的 ,故实际使月 时,常用其二钠盐,即乙二胺四乙酸二钠(Nhv·2H,0,相对分子质量372.24),一般 也简称EDTA。它在水溶液中的溶解度较大(22℃时,100mL水中能溶解11.1g),其饱和 水溶液的浓度约为0.3mol·L小H约为4.5
环己烷二胺四乙酸,简称 CyDTA: 乙二醇二乙醚二胺四乙酸(EGTA): 乙二胺四丙酸(EDTP): 氨竣配位剂中应用最为广泛的是 EDTA,它可以直接滴定或间接滴定几十种金属离子。 本章主要讨论以 EDTA 为配位剂,滴定金属离子的配位滴定法。 §5—2 EDTA 与金属离子的配合物及其稳定性 EDTA 的性质 乙一胺四乙酸(ethylen diamine tetraacetic acid,EDTA 或 EDTA 酸),它是个多元酸, 可用 H4Y 表示。EDTA 在水中的溶解度很小(22℃时,100 rnl 水中仅能溶解 0.02 g),也 难溶于酸和一般的有机溶剂,但易溶于氨溶液和苛性碱溶液中,生成相应的盐,故实际使用 时,常用其二钠盐,即乙二胺四乙酸二钠(Na2H2Y·2H2O,相对分子质量 372.24),一般 也简称 EDTA。它在水溶液中的溶解度较大(22℃时,100 mL 水中能溶解 11.1g),其饱和 水溶液的浓度约为 0.3 mol·L -l小 H 约为 4.5
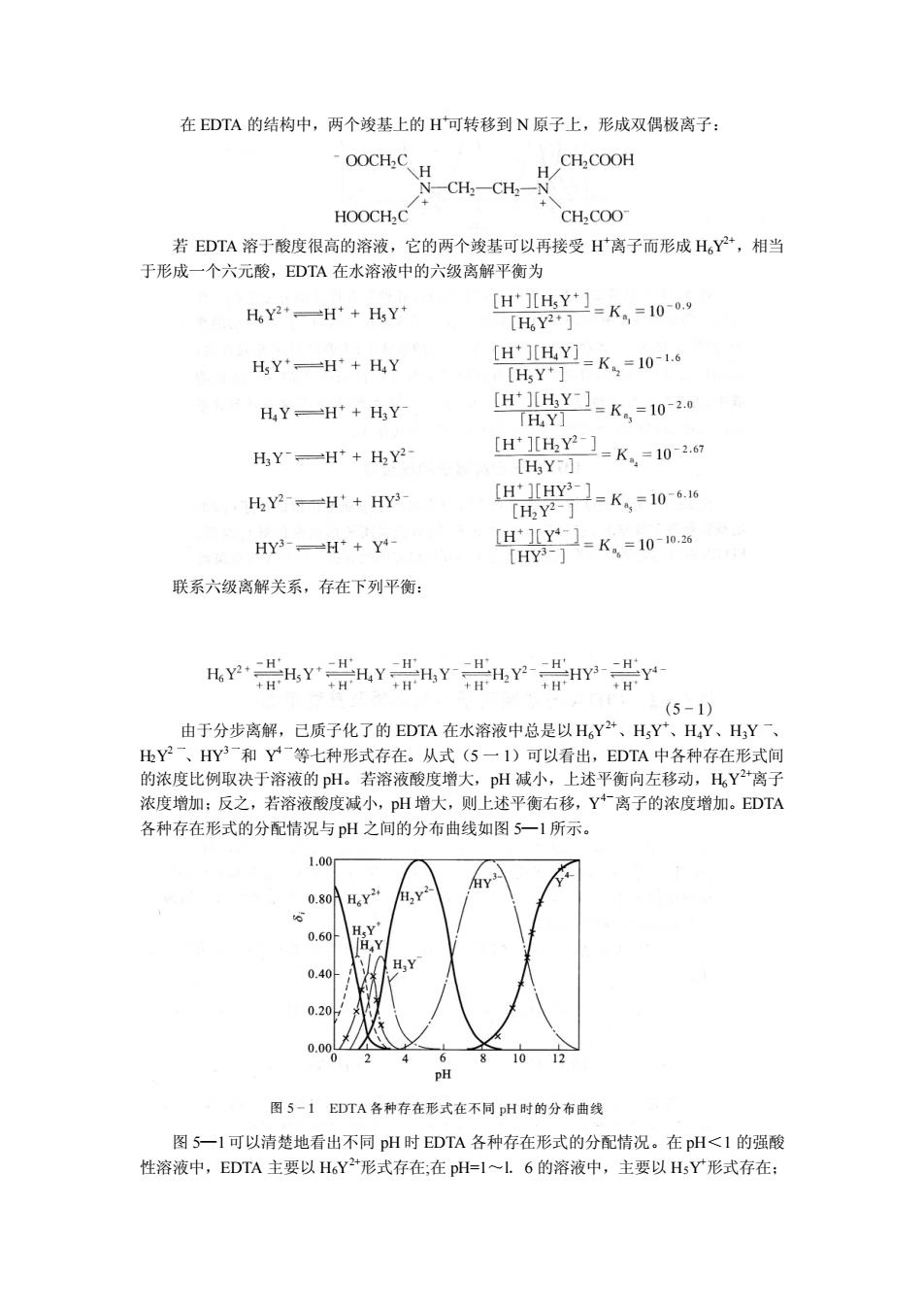
在EDTA的结构中,两个竣基上的H可转移到N原子上,形成双偶极离子: OOCH:C H HOOCH.C 若EDTA溶于酸度很高的溶液,它的两个竣基可以再接受H离子而形成H,Y+,相当 于形成一个六元酸,EDTA在水溶液中的六级离解平衡为 HeY2=H'+HY* 等-K,=0. HY*一H+HY H=K,=106 [HsY HY一H+HY [HY1=K=102 HY] HY一Ht+H2Y2 [H1Y21=K,=102 「HaY-l HY2-=H'+HY3- [HHY-]-K.=10 「H,y2-1 HY3-H+Y- 联系六级离解关系,存在下列平衡: YHYWHYH,YP是HYY (5-1) 由于分步离解,已质子化了的EDTA在水溶液中总是以HY+、HY、H,Y、HY 比Y2一、HY一和Y一等七种形式存在。从式(5一1)可以看出,EDTA中各种存在形式间 的浓度比例取决于溶液的pH。若溶液酸度增大,pH减小,上述平衡向左移动,H,Y+离子 浓度增加:反之,若溶液酸度减小,pH增大,则上述平衡右移,Y离子的浓度增加。EDTA 各种存在形式的分配情况与H之间的分布曲线如图5一1所示。 .00 .80 H Y pH 图5-1EDTA各种存在形式在不同pH时的分布曲线 图5一I可以清楚地看出不同pH时EDTA各种存在形式的分配情况。在pH<1的强酸 性溶液中,EDTA主要以H。Y形式存在,在pH=1~l6的溶液中,主要以H5Y形式存在
在 EDTA 的结构中,两个竣基上的 H +可转移到 N 原子上,形成双偶极离子: 若 EDTA 溶于酸度很高的溶液,它的两个竣基可以再接受 H +离子而形成 H6Y 2+,相当 于形成一个六元酸,EDTA 在水溶液中的六级离解平衡为 联系六级离解关系,存在下列平衡: 由于分步离解,已质子化了的 EDTA 在水溶液中总是以 H6Y 2+、H5Y +、H4Y、H3Y 一、 H2Y 2 一、HY3 一和 Y 4 一等七种形式存在。从式(5 一 1)可以看出,EDTA 中各种存在形式间 的浓度比例取决于溶液的 pH。若溶液酸度增大,pH 减小,上述平衡向左移动,H6Y 2+离子 浓度增加;反之,若溶液酸度减小,pH 增大,则上述平衡右移,Y 4-离子的浓度增加。EDTA 各种存在形式的分配情况与 pH 之间的分布曲线如图 5—1所示。 图 5—1可以清楚地看出不同 pH 时 EDTA 各种存在形式的分配情况。在 pH<1 的强酸 性溶液中,EDTA 主要以 H6Y 2+形式存在;在 pH=1~l.6 的溶液中,主要以 H5Y +形式存在;