
第四章炔烃和二烯烃 学习要求 1.掌握炔烃和共轭二烯烃的结构及化学性质,了解炔烃的物理性质: 2.掌握炔烃和二烯烃的命名: 3.理解炔烃与烯烃加成反应的差异及共轭二烯烃的1,2-加成和1,4-加成: 4.掌握共轭体系及共轭效应: 5.掌握炔烃的制备,了解一些重要的炔烃和二烯烃的用途: 6.理解速度控制和平衡控制的概念: 炔烃和二烯烃都是通式为C,H2的不饱和烃,炔烃是分子中含有-C=C-的不 饱和烃,二烯烃是含有两个碳碳双键的不饱和烃,它们是同分异构体,但结构 不同,性质各异。 §4-1快烃 一炔烃的结构 最简单的炔烃是乙炔,我们以乙炔来讨论三键的结构。 现代物理方法证明,乙炔分子是一个线型分子,分之中四个原子排在一条 直线上 0.106nm0.12nm HCC.H 杂化轨道理论认为三键碳原子既满足8电子 结构 180 结构和碳的四价,又形成直线型分子,故 三键碳原子 成键时采用了SP杂化方式· 1sp杂化轨道 口 团杂化 五 2p 一团本 团 25 sp 32
·32· 第四章 炔烃和二烯烃 学习要求 1.掌握炔烃和共轭二烯烃的结构及化学性质,了解炔烃的物理性质; 2.掌握炔烃和二烯烃的命名; 3.理解炔烃与烯烃加成反应的差异及共轭二烯烃的 1,2-加成和 1,4-加成; 4.掌握共轭体系及共轭效应; 5.掌握炔烃的制备,了解一些重要的炔烃和二烯烃的用途; 6.理解速度控制和平衡控制的概念; 炔烃和二烯烃都是通式为 CnH2n-2的不饱和烃,炔烃是分子中含有-C≡C-的不 饱和烃,二烯烃是含有两个碳碳双键的不饱和烃,它们是同分异构体, 但结构 不同,性质各异。 §4—1 炔 烃 一 炔烃的结构 最简单的炔烃是乙炔,我们以乙炔来讨论三键的结构。 现代物理方法证明,乙炔分子是一个线型分子,分之中四个原子排在一条 直线上 杂化轨道理论认为三键碳原子既满足 8电子 结构 结构和碳的四价,又形成直线型分子,故 三键碳原子 成键时采用了 SP 杂化方式 . 1 sp 杂化轨道 H C≡ C H 0.106nm 0.12nm 180° 2s 2p 2s 2p sp p 激发 杂化
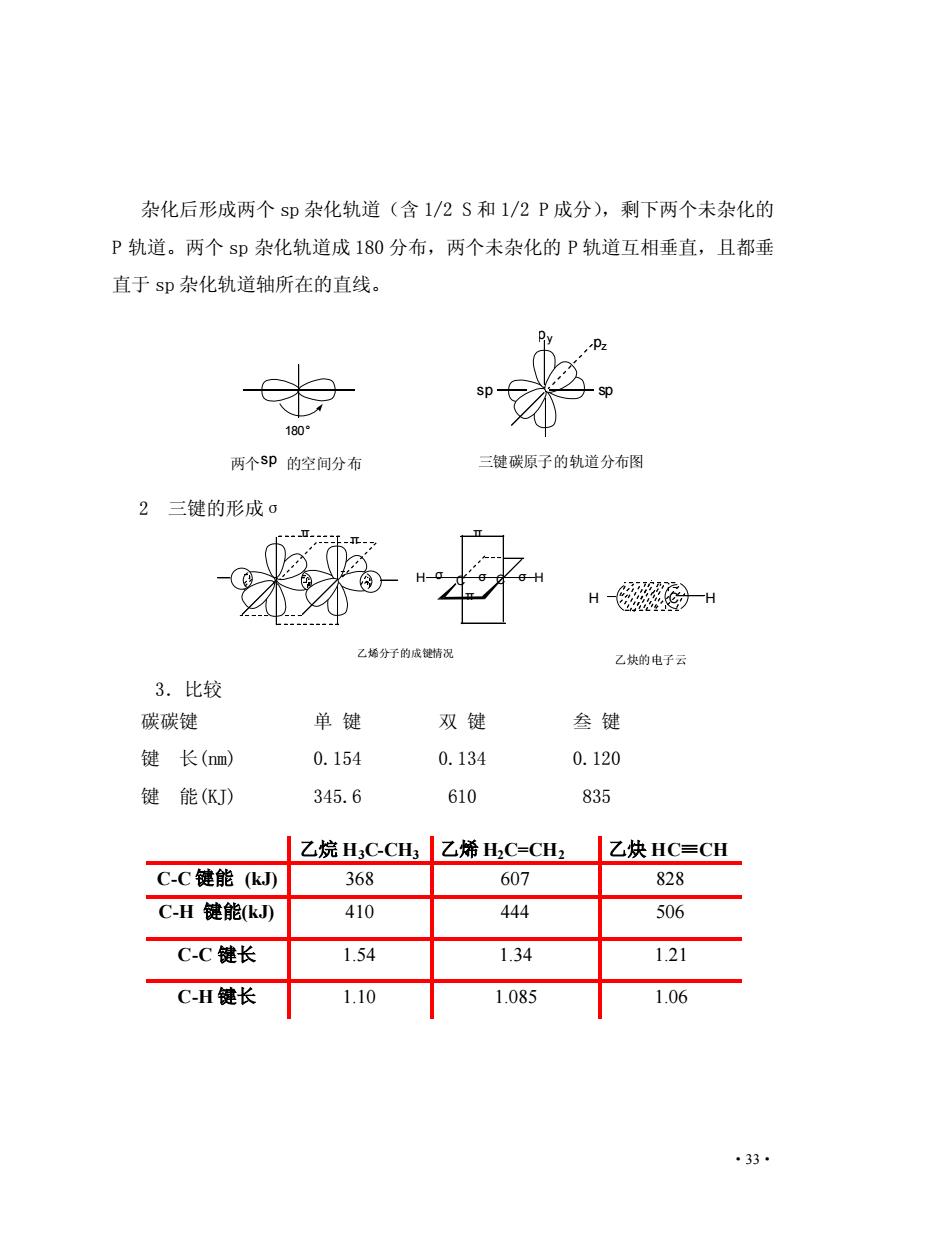
杂化后形成两个s即杂化轨道(含1/2S和1/2P成分),剩下两个未杂化的 P轨道。两个sp杂化轨道成180分布,两个未杂化的P轨道互相垂直,且都垂 直于sp杂化轨道轴所在的直线。 sp- 180 两个SP的空间分布 三键碳原子的轨道分布图 2三键的形成o H酸一H 乙棒分子的成觉情况 乙块的电子云 3.比较 碳碳键 单键 双键 叁键 键长(nm) 0.154 0.134 0.120 键能(KJ) 345.6 610 835 |乙烷HC-CH3|乙烯H,C=CH2|乙炔HC=CH C-C键能(kJ) 368 607 828 C-H键能k) 410 444 506 C-C键长 1.54 1.34 1.21 CH键长 1.10 1.085 1.06 33
·33· 杂化后形成两个 sp 杂化轨道(含 1/2 S 和 1/2 P 成分),剩下两个未杂化的 P 轨道。两个 sp 杂化轨道成 180 分布,两个未杂化的 P 轨道互相垂直,且都垂 直于 sp 杂化轨道轴所在的直线。 2 三键的形成σ 3.比较 碳碳键 单 键 双 键 叁 键 键 长(nm) 0.154 0.134 0.120 键 能(KJ) 345.6 610 835 乙烷 H3C-CH3 乙烯 H2C=CH2 乙炔 HC≡CH C-C 键能 (kJ) 368 607 828 C-H 键能(kJ) 410 444 506 C-C 键长 1.54 1.34 1.21 C-H 键长 1.10 1.085 1.06 180° sp sp py pz 两个sp 的空间分布 三键碳原子的轨道分布图 H C C H π π π π σ σ σ 乙烯分子的成键情况 H C H 乙炔的电子云

二快烃的命名 1炔烃的系统命名法和烯烃相似,只是将“烯”字改为“炔”字。 2烯炔(同时含有三键和双键的分子)的命名: (1)选择含有三键和双键的最长碳链为主链。 (2)主链的编号遵循链中双、三键位次最低系列原则。 (3)通常使双键具有最小的位次。 三快烃的化学性质 1亲电加成 R-CEC-R+Br2→RC0 Br R. BrBr R -C-R Br Br Br2 R- BrBr H X RC=CR+HX-RCH-GR HX- H X (1)R-C三C-H与Hⅸ等加成时,遵循马氏规则。 (2)炔烃的亲电加成比烯烃困难。例如: CH=OH+Br/Cc,→ 溴褪色快 HC=C-H+Br,/CCL,→ 溴褪色慢 -CH2=CH-CI b H-C=C-H HCI Haclc 120-180 氯乙烯 CHCHCNC.CH D/CCCC.CH 原因:1°炔碳原子是s即杂化的,杂化轨道中S的成分大,S的成分大, 键长就越短,键的离解能就越大。 2°两个轨道分布与键的四周,重叠程度比乙烯中的要大,比双键 34
·34· 二 炔烃的命名 1 炔烃的系统命名法和烯烃相似,只是将“烯”字改为“炔”字。 2 烯炔(同时含有三键和双键的分子)的命名: (1)选择含有三键和双键的最长碳链为主链。 (2)主链的编号遵循链中双、三键位次最低系列原则。 (3)通常使双键具有最小的位次。 三 炔烃的化学性质 1 亲电加成 (1) R-C≡C-H 与 HX 等加成时,遵循马氏规则。 (2) 炔烃的亲电加成比烯烃困难。例如: a CH2=CH2 + Br2/CCl4 溴褪色快 H-C≡C-H + Br2/CCl4 溴褪色慢 b c 原因: 1° 炔碳原子是 sp 杂化的,杂化轨道中 S 的成分大,S 的成分大, 键长就越短,键的离解能就越大。 2° 两个轨道分布与键的四周,重叠程度比乙烯中的要大,比双键 Br2 R-C=C R' Br Br C=C R Br Br R' Br2 R C C R Br Br Br Br R-C≡ C-R' R-C ≡ C-R' HX R-CH=C-R' X HX R C C R' X X H H H C≡ C H HCl HgCl2 /C 120~180℃ CH2 =CH-Cl 氯乙烯 CH2=CH-CH2 -C CH Br2 /CCl4 CH2 -CH-CH2 -C CH ≡ ≡ Br Br
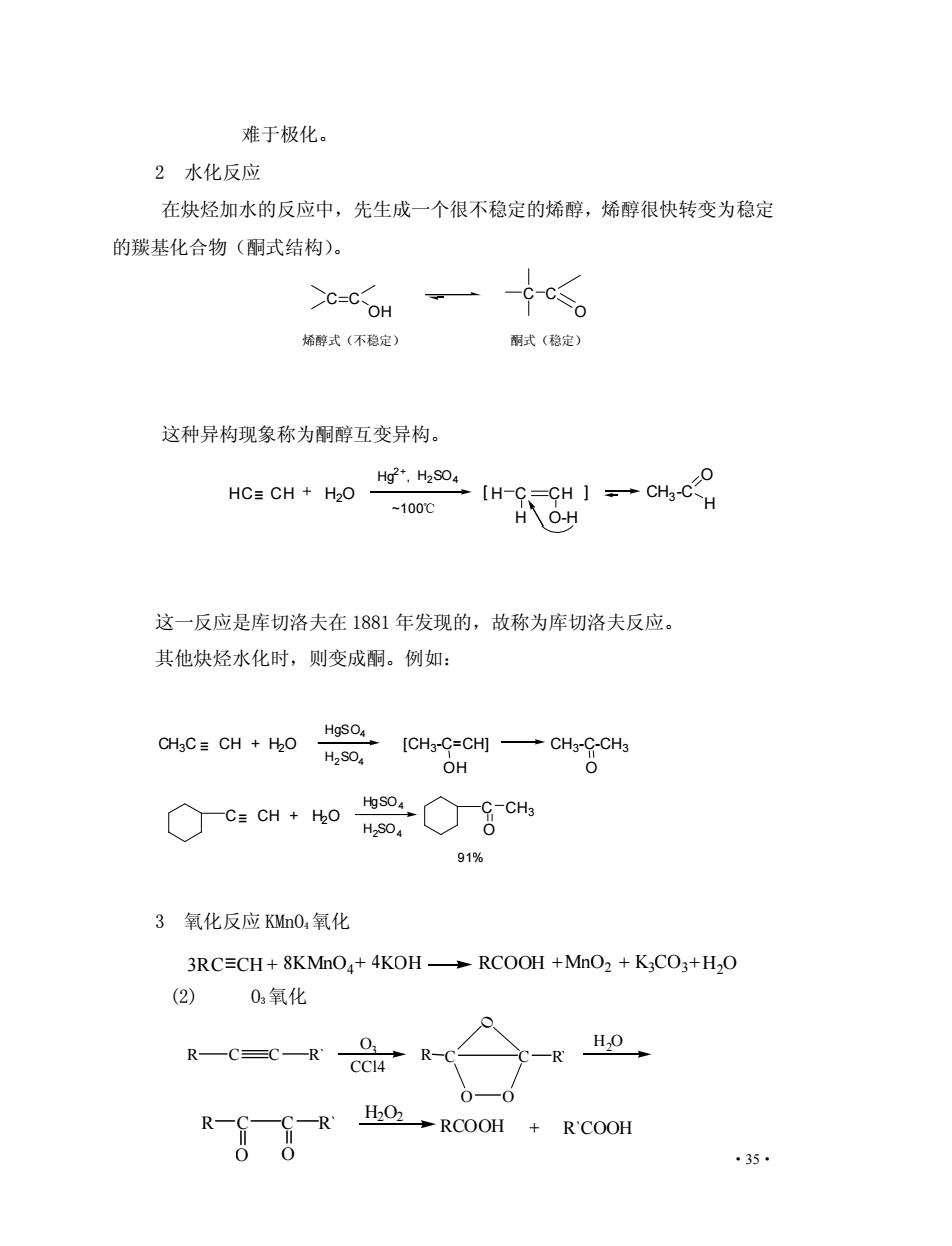
难于极化。 2水化反应 在炔烃加水的反应中,先生成一个很不稳定的烯醇,烯醇很快转变为稳定 的羰基化合物(酮式结构)。 C-C-OH ≤ 烯醇式(不稳定) 酮式(稳定) 这种异构现象称为酮醇互变异构。 HC=CH+HOHH. -100℃ H八0-H 这一反应是库切洛夫在1881年发现的,故称为库切洛夫反应。 其他炔烃水化时,则变成酮。例如: HgsO H2S04 [CH-G-cH一CH-GCH OH Oc:em+o☏◇8时 91% 3氧化反应MnO,氧化 3RC=CH+8KMnO+4KOH-RCOOH +MnO2+K3CO3+H2O (2)02氧化 R CC R R-C 一R 0—0 +R'COOH 35
·35· 难于极化。 2 水化反应 在炔烃加水的反应中,先生成一个很不稳定的烯醇,烯醇很快转变为稳定 的羰基化合物(酮式结构)。 这种异构现象称为酮醇互变异构。 这一反应是库切洛夫在 1881 年发现的,故称为库切洛夫反应。 其他炔烃水化时,则变成酮。例如: 3 氧化反应 KMnO4氧化 (2) O3氧化 HC≡ CH H2O Hg 2+ , H2SO4 ~100℃ [ H C CH ] H O-H CH3-C O H CH3C CH + H2O HgSO4 H2SO4 [CH3 -C=CH] CH3 -C-CH3 O ≡ C≡ CH + H2O HgSO4 H2SO4 C CH3 O 91% OH C C OH C C O 烯醇式(不稳定) 酮式(稳定) 3RC CH + 8KMnO4+ 4KOH RCOOH +MnO2 + K3CO3+H2O R C C R` CCl4 O3 R C C R` O O O H2O R C C R` O O H2O2 RCOOH + R`COOH

4炔化物的生产成 三键碳上的氢原子具有微弱酸性(pK=25),可被金属取代,生成炔化物。 2AgNO3+2NHOH-CC-Ag+2NH NO3+H H-C=C-H- 乙快银(白色) 2CuCI2+2NH4OH Cu-C=C-Cu+2NH4CI+2H2O 乙炔亚铜(棕红色) Ag(NHa)2,RC=CAg换银(自 R-Cs G Cu泛RC=C-C0然传 生成炔银、炔铜的反应很灵敏,现象明显,可用来鉴定乙炔和端基炔烃。 干燥的炔银或炔铜受热或震动时易发生爆炸生成金属和碳。 Ag-C=C-Ag 2Ag 2C 364KJ/mol 所以,实验完毕,应立即加盐酸将炔化物分解,以免发生危险。 Ag-C=C-Ag 2HC1>H-C=C-H +AgCl 乙炔和RC三C-H在液态氨中与氨基钠作用生成炔化钠。 2 H-CsC-H+2N阳N波态氢.H-CE G-Nd+NH NH3(L) 快化销是股行的有机浴波中同体可眉来答低块经的同系物。例如: CHCHC=CNa CHCHCHBr> CHCH-C=CCH-CHCH NaBr R-X=1°RX 说明:炔氢较活泼的原因是因=C-H键是sps键,其电负性Csp> Hs(Csp=3.29, Hs=2.2),因而显极性,具有微弱的酸性 5还原(加氢)反应 (1)催化加氢 R-C=C-R'+H2- NR-CH-CH-R HNR-CH-CH-R 催化氢化常用的催化剂为Pt,P,Ni,但一般难控制在烯烃阶段。 ·36
·36· 4 炔化物的生产成 三键碳上的氢原子具有微弱酸性(pKa=25),可被金属取代,生成炔化物。 生成炔银、炔铜的反应很灵敏,现象明显,可用来鉴定乙炔和端基炔烃。 干燥的炔银或炔铜受热或震动时易发生爆炸生成金属和碳。 Ag-C≡C-Ag 2Ag + 2C + 364KJ/mol 所以,实验完毕,应立即加盐酸将炔化物分解,以免发生危险。 Ag-C≡C-Ag + 2HCl H-C≡C-H + 2AgCl 乙炔和 RC≡C-H 在液态氨中与氨基钠作用生成炔化钠。 炔化钠是很有用的有机合成中间体,可用来合成炔烃的同系物。例如: CH3CH2C≡CNa + CH3CH2CH2Br CH3CH2C≡CCH2CH2CH3 + NaBr R-X=1°RX 说明: 炔氢较活泼的原因是因 ≡C-H 键是 sp-s 键,其电负性 Csp > Hs(Csp=3.29, Hs=2.2),因而显极性,具有微弱的酸性。 5 还原(加氢)反应 (1) 催化加氢 催化氢化常用的催化剂为 Pt , Pd , Ni,但一般难控制在烯烃阶段。 H-C≡ C-H 2AgNO3 + 2NH4OH 2Cu2Cl 2+ 2NH4OH Ag-C≡ C-Ag Cu-C≡ C-Cu 2NH4NO3 + 2H2O 2NH4Cl + 2H2O R-C≡ C-H R-C≡ C-Ag R-C≡ C-Cu Cu(NH3 ) 2 + Ag(NH3 )2 + 乙炔银(白色) 乙炔亚铜(棕红色) 炔铜(棕红 ) 炔银(白 ) 2H-C≡ C-H 2NaNH2 H-C≡ C-Na NH3 R-C≡ C-H NaNH2 R-C≡ C-Na NH3 NH3 (L) 液态氨 R-C C-R' H2 Ni ≡ R-CH=CH-R' H2 , Ni R-CH2 -CH2 -R