
第四章酸碱滴定法 酸碱滴定法所涉及的反应是酸碱反应,因此,首先必须对酸碱平衡的基础理论进行简 要的讨论,然后再介绍酸碱滴定法的有关理论和应用。 §4一1酸碱平衡的理论基础 众所周知,根据酸碱电离理论,电解质离解时所生成的阳离子全部是的是酸,离解 时所生成的阴离子全部是OH一是碱。例如: 酸 HOAc =H*+OAc- NaOH—Na+OH 酸碱发生中和反应生成盐和水。 NaOH HOAc NaOAc HO 但电离理论有一定局限性,它只适用于水溶液,不适用于非水溶液,而且也不能解释 有的物质(如NH,等)不含OH~,但却具有碱性的事实。为了进一步认识酸碱反应的本 质和便于对水溶液和非水溶液中的酸碱平衡问题统一加以考虑,现引人酸碱质子理论。 酸碱质子理论 酸碱质子理论(proton theory)是在1923年由布朗斯台德(Br中nsted)提出的。根据 质子理论, 凡是能给出质子()的物质是酸:凡是能接受质子的物质是碱,它们之间的 关系可用下式表示之 酸一厨子+碱 例如: HOAc =H*+OAc 上式中的HOAC是酸,它给出质子后,转化成的OAC~对于质子具有一定的亲和力, 能接受质子,因而OC~是一种碱。这种因一个质子的得失而互相转变的每一对酸碱,称 为共轭酸碱对。关于共轭酸碱对还可再举数例如下: HCO,一H+ClO HSOH++SO N一H+NH H2PO:一H+HPO房 HPO一H+PO 失去结晶水,因此应把它保存在相对湿度为60%的恒湿器中。 硼砂 准物的标定反应为 NazB:O+2HCI 5H2O-4H,BO3+2NaCl 以甲基红指示终点,变色明显
第四章 酸碱滴定法 酸碱滴定法所涉及的反应是酸碱反应,因此,首先必须对酸碱平衡的基础理论进行简 要的讨论,然后再介绍酸碱滴定法的有关理论和应用。 §4—1 酸碱平衡的理论基础 众所周知,根据酸碱电离理论,电解质离解时所生成的阳离子全部是 H+的是酸,离解 时所生成的阴离子全部是 OHˉ 是碱。例如: 酸 碱 酸碱发生中和反应生成盐和水: 但电离理论有一定局限性,它只适用于水溶液,不适用于非水溶液,而且也不能解释 有的物质(如 NH3 等)不含 OHˉ,但却具有碱性的事实。为了进一步认识酸碱反应的本 质和便于对水溶液和非水溶液中的酸碱平衡问题统一加以考虑,现引人酸碱质子理论。 酸碱质子理论 酸碱质子理论(proton theory)是在 1923 年由布朗斯台德(BrФnsted)提出的。根据 质子理论,凡是能给出质子(H +)的物质是酸;凡是能接受质子的物质是碱,它们之间的 关系可用下式表示之: 例如: 上式中的 HOAc 是酸,它给出质子后,转化成的 OACˉ 对于质子具有一定的亲和力, 能接受质子,因而 OACˉ是一种碱。这种因一个质子的得失而互相转变的每一对酸碱,称 为共轭酸碱对。关于共轭酸碱对还可再举数例如下: 失去结晶水,因此应把它保存在相对湿度为 60%的恒湿器中。 硼砂基准物的标定反应为 以甲基红指示终点,变色明显

诚标准溶液 mol·L,但有时需用到浓度高达 NaCO,而且NaOH还可能含有硫酸盐、硅酸盐、氯化物等杂质,因此应采用间接法配制 其标准溶液,即配成近似浓度的碱溶液,然后加以标定。 含有Na,CO3的标准碱溶液在用甲基橙作指示剂滴定强酸时,不会因Na,CO,的存在而 NaCO,仅交换 用到生成NaHCO,于是就会引起 的标准减溶液。 可用不同方法配制不含CO,的标淮碱溶液。最常用的方法是取一份纯净NOH,加 人一份水,搅拌,使之溶解,配成50%的浓溶液。在这种浓溶液中NCO,的溶解度很小, 待NaCO沉降后,吸取卜层澄清液,稀释至所需浓度。 由于NaOH 一般只在其表面形成 ,因此亦可称取较多的NaOH固体 于烧杯中,以蒸馏水洗涤二三次,每次用水少许,以洗去表面的少许NCO,倾去洗涤液, 留下固体NOH,配成所需浓度的碱溶液。为了配制不含CO,的碱溶液,所用蒸缩水亦应 不含C01。 为了标定NaOH溶液,可用客种基准物,如HC,O·2H,O、KHCO、苯甲酸等。但 最常用的是邻苯二甲酸氢钾。这种基准物容易用重结晶法制得纯品,不含结晶水,不吸湖, 容易保存,标定时,由于称量而造成的误差也较小(见S3一5,例4),因而是一种良好的 基准物 标定反应为 COOK COOK +NH一C +HO COOH COONa 由于邻苯二甲酸的PKa2=5.54。因此采用酚鼠指示终点时,变色相当敏锐. 'H;N-R-NHj H'+*H3N-R-NH2 可见酸碱可以是阳离子、阴离子,也可以是中性分子。 上面各个共轭酸碱对的质子得失反应,称为酸碱半反应,它们和氧化还原反应中的半电 池反应相类似。由于质子的半径极小,电荷密度极高,它不可能在水溶液中独立存在(或者 说只能瞬间存在),因此上述的各种酸碱半反应在溶液中也不能单独进行 ,而是当 种酸 出质子时,溶液中必定有一种碱来接受质子。例如HOA©在水溶液中离解时,作为溶剂的 水就是接受质子的碱,它们的反应可以表示如下:
碱标准溶液 碱标准溶液一般用 NaOH 配制,最常用浓度为 0.lmol·L -l,但有时需用到浓度高达 lmol·L -l 或低到 0.01 mol·L -l 的。NaOH 易吸潮,也易吸收空气中的 CO2,以致常含有 Na2CO3,而且 NaOH 还可能含有硫酸盐、硅酸盐、氯化物等杂质,因此应采用间接法配制 其标准溶液,即配成近似浓度的碱溶液,然后加以标定。 含有 Na2CO3的标准碱溶液在用甲基橙作指示剂滴定强酸时,不会因 Na2CO3 的存在而 引人误差;如用来滴定弱酸,用酚酞作指示剂,滴到酚酞出现浅红色时,Na2CO3 仅交换二 个质子,即作用到生成 NaHCO3,于是就会引起一定的误差。因此应配制和使用不含 CO3 2- 的标准碱溶液。 可用不同方法配制不含 CO3 2-的标准碱溶液。最常用的方法是取一份纯净 NaOH,加 人一份水,搅拌,使之溶解,配成 50%的浓溶液。在这种浓溶液中 Na2CO3的溶解度很小, 待 Na2CO3沉降后,吸取卜层澄清液,稀释至所需浓度。 由于 NaOH 固体一般只在其表面形成一薄层 Na2CO3,因此亦可称取较多的 NaOH 固体 于烧杯中,以蒸馏水洗涤二三次,每次用水少许,以洗去表面的少许 Na2CO3,倾去洗涤液, 留下固体 NaOH,配成所需浓度的碱溶液。为了配制不含 CO3 2-的碱溶液,所用蒸馏水亦应 不含 CO2。 为了标定 NaOH 溶液,可用各种基准物,如 H2C2O4·2H2O、KHC2O4、苯甲酸等。但 最常用的是邻苯二甲酸氢钾。这种基准物容易用重结晶法制得纯品,不含结晶水,不吸潮, 容易保存,标定时,由于称量而造成的误差也较小(见§3—5,例 4),因而是一种良好的 基准物。 标定反应为 由于邻苯二甲酸的 PKa2=5.54。因此采用酚酞指示终点时,变色相当敏锐。 可见酸碱可以是阳离子、阴离子,也可以是中性分子。 上面各个共轭酸碱对的质子得失反应,称为酸碱半反应,它们和氧化还原反应中的半电 池反应相类似。由于质子的半径极小,电荷密度极高,它不可能在水溶液中独立存在(或者 说只能瞬间存在),因此上述的各种酸碱半反应在溶液中也不能单独进行,而是当一种酸给 出质子时,溶液中必定有一种碱来接受质子。例如 HOAc 在水溶液中离解时,作为溶剂的 水就是接受质子的碱,它们的反应可以表示如下:

HOAc H'+OAc 酸 碱, H,0+H* 碱2 酸2 HOAc+H,O一H,O+OA 酸1碱 酸2碱1 两个共轭酸碱对相互作用而达平衡,这也和两个半电池反应相互结合而成氧化还原反应 相类似。 同样,碱在水溶液中接受质子的过程,也必须有溶剂水分子参加。例如: NH+H' 0一H*+OH NHs+H.O OH+NH 司样也是两个共银酸碱对相互作用而达平衡。在这个平衡中作为溶剂的水起了酸的作用。与 HOAC在水中离解的情况相比较可知,水是一种两性溶剂 由于水分子的两性作用, 个水分子可以从另一个水分子夺取质子而形成H0和O州“,即 H,0+H,0一H0+OH 在水分子之间存在着的质子传递作用,称为水的质子自递作用。这种作用的平衡常数称为水 的质子自递常数,用Kw表示: K.=[HO*][OH- 水合质子H,0也常常简写作矿,因此水的质子自递常数常简写作: K.=[H'][OH- 这个常数就是水的离子积,在25℃时等于104,于是 K.=1014 pK.=14 根据质子理论,酸和碱的中和反应也是一种质子的转移过程,例如HCI与NH反应: HCI+H20一H0+C HO'+NH NH+H2O 反应的结果是各反应物转化为它们各自的共轭酸或共轭碱 人们通常说的盐的水解过程,实质上也是质子的转移过程。它们和酸碱离解过程在本质 上是相同的,例如:
两个共轭酸碱对相互作用而达平衡,这也和两个半电池反应相互结合而成氧化还原反应 相类似。 同样,碱在水溶液中接受质子的过程,也必须有溶剂水分子参加。例如: 同样也是两个共轭酸碱对相互作用而达平衡。在这个平衡中作为溶剂的水起了酸的作用。与 HOAc 在水中离解的情况相比较可知,水是一种两性溶剂。 由于水分子的两性作用,一 个水分子可以从另一个水分子夺取质子而形成 H3O +和 OHˉ,即 在水分子之间存在着的质子传递作用,称为水的质子自递作用。这种作用的平衡常数称为水 的质子自递常数,用 KW 表示: 水 合 质 子 H3O + 也 常 常 简 写 作 H + , 因 此 水 的 质 子 自 递 常 数 常 简 写 作 : 这个常数就是水的离子积,在 25℃时等于 10-14,于是 根据质子理论,酸和碱的中和反应也是一种质子的转移过程,例如 HCI 与 NH3 反应: 反应的结果是各反应物转化为它们各自的共轭酸或共轭碱。 人们通常说的盐的水解过程,实质上也是质子的转移过程。它们和酸碱离解过程在本质 上是相同的,例如:

HOAe+H,OH,O+OAe 离解 H2O NH3 NHi+OH- 离解 酸 碱 碱 H2O+OAc HOAc OH 水解 NH+H2O H:O'+NH 水解 酸! 酸2碱 上述的最后两个反应式也可分别看作HOAc的共轭碱OAC的离解反应和NHB的共 钜酸N4+的离解反应。总之,各种酸碱反应过程都是质子转移过程,因此运用质子理论就 可以找出各种酸碱反应的共同基本特征。 酸威离解平衡 酸碱的强弱取决于物质给出质子或接受质子能力的强弱。给出质子的能力越强,酸性 就越强:反之就越弱。同样,接受质子的能力越强,碱性就越强:反 这就定量说明了,酸越强,其共轭碱越弱:反之,酸越弱,它的共钜碱越强的规律 4一2不同pH溶液中酸碱存在形式的分布情况——一分布曲线 从酸(或碱)离解反应式可知,当共轭酸碱对处于平衡状态时,溶液中存在着0利 不同的酸碱形式。这时它们的浓度称为平衡浓度(equilibrium con-一centration),各种存在形 式平衡浓度之和称为总浓度或分析浓度(analytical con-一centration),某一存在形式的平衡 浓度占总浓度的分数,即为该存在形式的分布系数(dstribution coef伍icient),以6表示之。 当溶液的p发生变化时,平衡随之移动,以致酸碱存在形式的分布情祝也跟着变化。分布 系数6 溶液PH间的关系曲线称为分布曲线 distribution curve ) 讨论分布曲线可帮助我 们深人理解酸碱滴定的过程、终点误差以及分步滴定的可能性,而且也有利于了解配位滴定 与沉淀反应条件的选择原则。现对一元酸、二元酸和三元酸的分布系数的计算和分布曲线分 别讨论如下。 一元酸例如HOAc,设它的总浓度为c。它在溶液中以HOAc和OAc两种形式存 在,它们的平 衡浓度 分别为 HOAc]和OAG ],则C=[HOAc]+OAe~,又设HOA 所占的分数为6,OAc所占的分数为8,则 H1 THOA IH I
上述的最后两个反应式也可分别看作 HOAc 的共轭碱 OACˉ 的离解反应和 NH3 的共 轭酸 NH4+的离解反应。总之,各种酸碱反应过程都是质子转移过程,因此运用质子理论就 可以找出各种酸碱反应的共同基本特征。 酸碱离解平衡 酸碱的强弱取决于物质给出质子或接受质子能力的强弱。给出质子的能力越强,酸性 就越强;反之就越弱。同样,接受质子的能力越强,碱性就越强;反 这就定量说明了,酸越强,其共轭碱越弱;反之,酸越弱,它的共轭碱越强的规律。 4-2 不同 pH 溶液中酸碱存在形式的分布情况-分布曲线 从酸(或碱)离解反应式可知,当共轭酸碱对处于平衡状态时,溶液中存在着 H3O +和 不同的酸碱形式。这时它们的浓度称为平衡浓度(equilibrium con-centration),各种存在形 式平衡浓度之和称为总浓度或分析浓度(analytical con-centration),某一存在形式的平衡 浓度占总浓度的分数,即为该存在形式的分布系数(dstribution coefficient),以δ表示之。 当溶液的 pH 发生变化时,平衡随之移动,以致酸碱存在形式的分布情况也跟着变化。分布 系数δ与溶液 PH 间的关系曲线称为分布曲线(distribution curve)。讨论分布曲线可帮助我 们深人理解酸碱滴定的过程、终点误差以及分步滴定的可能性,而且也有利于了解配位滴定 与沉淀反应条件的选择原则。现对一元酸、二元酸和三元酸的分布系数的计算和分布曲线分 别讨论如下。 一元酸 例如 HOAc,设它的总浓度为 c。它在溶液中以 HOAc 和 OAcˉ两种形式存 在,它们的平衡浓度分别为[HOA c]和[OAcˉ],则 C=[HOA c]+[OAcˉ]。又设 HOAc 所占的分数为δ1,OAcˉ所占的分数为δ0,则
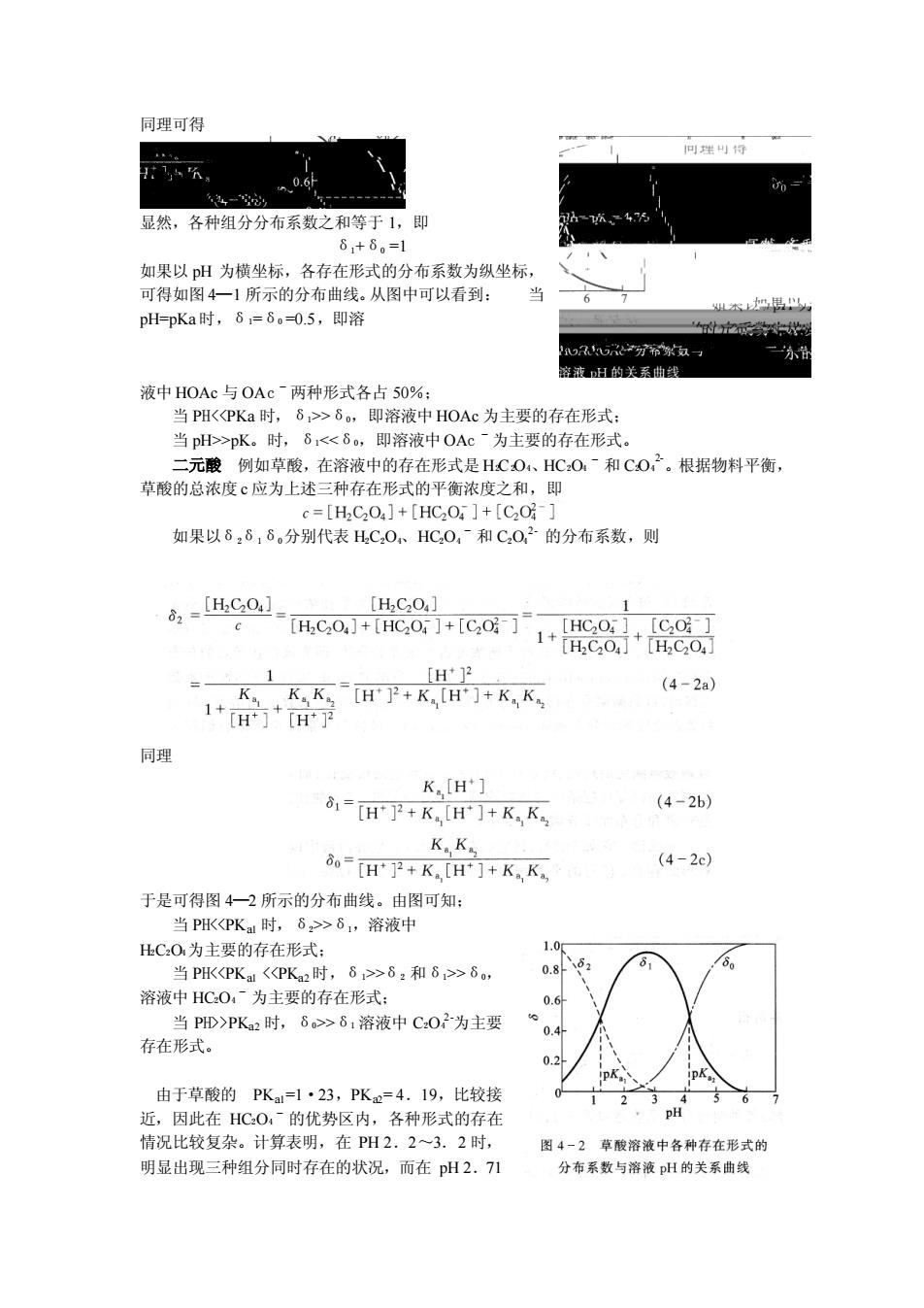
同理可得 显然,各种组分分布系数之和等于1,即 6,+8。=1 如果以pH为横坐标,各存在形式的分布系数为纵坐标, 可得如图4一1所示的分布曲线。从图中可以看到: pH=pKa时,6=6=0.5,即溶 密H的关系曲线 液中HOAc与OAcˉ两种形式各占50%: 当P阳<PKa时,6>6。,即溶液中HOAc为主要的存在形式 当pH>pK。时,1<6。,即溶液中OAC 为主要的存在形式。 二元酸例如草酸,在溶液中的存在形式是HC0、HC:0~和C0,2。根据物料平衡, 草酸的总浓度c应为上述三种存在形式的平衡浓度之和,即 c=[H2C2O4]+[HC2O ]+[C20-] 如果以8:6,8。分别代表HC,0、HC0,和C,0,2的分布系数,则 4c01+HC0+co71+e8+C0 「HCO 「C02-1 K,K[H2+KH门+KK (4-2a 同理 K,[H*] 81-HK[H]+K.K. (4-2b) KK 80=KH]+KK (4-2c) 于是可得图4一2所示的分布曲线。由图可知: 当PHK<P水时,8>>8,溶液中 出C:O为主要的存在形式: 1.0 当PH<PKaPKa时 6>62和81>8 0.86 溶液中HCOˉ为主要的存在形式: 0.6 当PD>PK2时,6>61溶液中C02为主要 存在形式。 0.2 由于草酸的PK=1·23,PK=4.19,比较接 12 近,因此在HC0的优势区内,各种形式的存在 情祝比较复杂。计算表明,在PH2.2一3.2时, 图4一2草酸溶液中各种存在形式的 明显出现三种组分同时存在的状况,而在pH2.71 分布系数与溶液H的关系曲线
同理可得 显然,各种组分分布系数之和等于 1,即 δ1+δ0 =1 如果以 pH 为横坐标,各存在形式的分布系数为纵坐标, 可得如图 4—1 所示的分布曲线。从图中可以看到: 当 pH=pKa 时,δ1=δ0 =0.5,即溶 液中 HOAc 与 OAcˉ两种形式各占 50%; 当 PH<<PKa 时,δ1>>δ0,即溶液中 HOAc 为主要的存在形式; 当 pH>>pK。时,δ1<<δ0,即溶液中 OAcˉ为主要的存在形式。 二元酸 例如草酸,在溶液中的存在形式是 H2C2O4、HC2O4ˉ和 C2O4 2-。根据物料平衡, 草酸的总浓度 c 应为上述三种存在形式的平衡浓度之和,即 如果以δ2δ1δ0分别代表 H2C2O4、HC2O4ˉ和 C2O4 2- 的分布系数,则 同理 于是可得图 4—2 所示的分布曲线。由图可知; 当 PH<<PKa1 时,δ2>>δ1,溶液中 H2C2O4为主要的存在形式; 当 PH<<PKa1 <<PKa2时,δ1>>δ2 和δ1>>δ0, 溶液中 HC2O4ˉ为主要的存在形式; 当 PH>>PKa2 时,δ0>>δ1 溶液中 C2O4 2-为主要 存在形式。 由于草酸的 PKa1=1·23,PKa2= 4.19,比较接 近,因此在 HC2O4ˉ的优势区内,各种形式的存在 情况比较复杂。计算表明,在 PH 2.2~3.2 时, 明显出现三种组分同时存在的状况,而在 pH 2.71