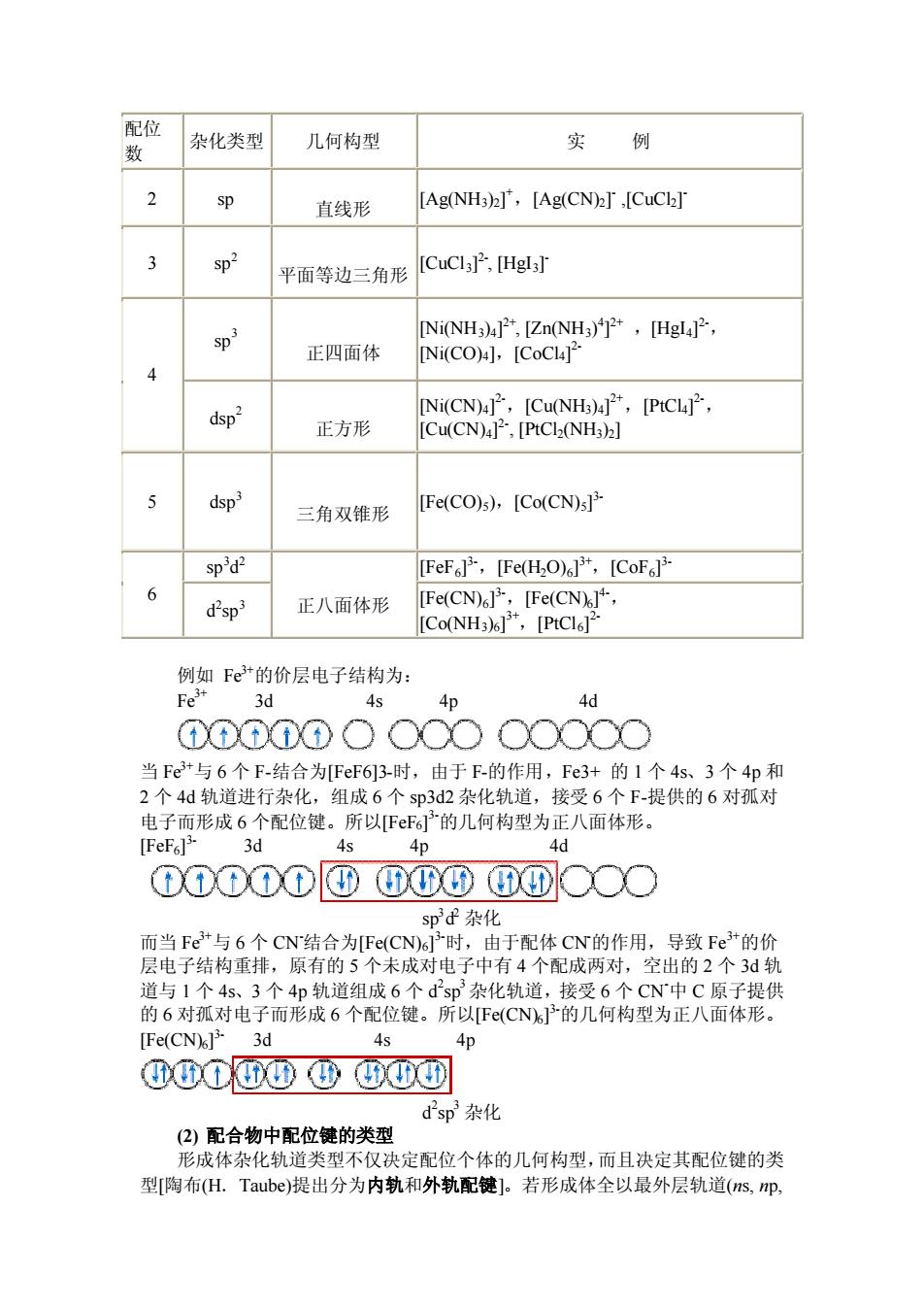
配位 杂化类型 几何构型 实例 数 2 sp 直线形 [Ag(NH3)],[Ag(CN)T ,[CuCk] 3 平面等边三角形 [CuCI3P,[HgI3] sp [Ni(NH3)4].[Zn(NH3),[HgI]2 正四面体 INi(CO)l,ICoCLT 4 dsp" [Ni(CN)4]",[Cu(NH3)4],[PtCl]", 正方形 [Cu(CN)42,[PtCl2(NH3)2] 5 dsp3 三角双锥形 [Fe(CO)s),[Co(CN)s] spd2 [FeF],[Fe(HO),[CoFB d'sp 正八面体形 [Fe(CN)],[Fe(CN], ICo(NH3)1,[PtCls12 例如Fe3+的价层电子结构为: 3d As 4d ①00①0O○○O○○○○○ 当Fer与6个F.结合为FeF63-时,由于E的作用,Fe3+的1个4s、3个4p和 2个4d轨道进行杂化,组成6个sp3d2杂化轨道,接受6个F-提供的6对孤对 电子而形成6个配位键。所以F萨的几何构型为正八面体形。 [FeFsl> 3d 4s An Ad ①①O①①DG0⑩④①○○○ spd杂化 而当FE+与6个CN结合为F(CN6子时,由于配体CN的作用,导致Fe的价 层电子结构重排,原有的5个未成对电子中有4个配成两对,空出的2个3d轨 道与1个4s、3个4D轨道组成6个dsD3杂化轨道,接受6个CN中C原子提供 的6对孤对电子而形成6个配位键。所以e(CN的几何构型为正八面体形。 [Fe(CN)] 3d 45 4p ④GXT00④G0G d2sp3杂化 (2)配合物中配位键的类型 形成体杂化轨道类型不仅决定配位个体的几何构型,而且决定其配位键的类 型[陶布(H.Taube)提出分为内轨和外轨配键]。若形成体全以最外层轨道(s,m
配位 数 杂化类型 几何构型 实 例 2 sp 直线形 [Ag(NH3)2] +,[Ag(CN)2] - ,[CuCl2] - 3 sp2 平面等边三角形 [CuCl3] 2- , [HgI3] - sp 3 正四面体 [Ni(NH3)4] 2+, [Zn(NH3) 4 ] 2+ ,[HgI4] 2-, [Ni(CO)4],[CoCl4] 2- 4 dsp 2 正方形 [Ni(CN)4] 2-,[Cu(NH3)4] 2+,[PtCl4] 2-, [Cu(CN)4] 2- , [PtCl2(NH3)2] 5 dsp3 三角双锥形 [Fe(CO)5),[Co(CN)5] 3- sp3 d 2 [FeF6] 3-,[Fe(H2O)6] 3+,[CoF6] 3- 6 d 2 sp3 正八面体形 [Fe(CN)6] 3-,[Fe(CN)6] 4-, [Co(NH3)6] 3+,[PtCl6] 2- 例如 Fe3+的价层电子结构为: Fe3+ 3d 4s 4p 4d 当 Fe3+与 6 个 F-结合为[FeF6]3-时,由于 F-的作用,Fe3+ 的 1 个 4s、3 个 4p 和 2 个 4d 轨道进行杂化,组成 6 个 sp3d2 杂化轨道,接受 6 个 F-提供的 6 对孤对 电子而形成 6 个配位键。所以[FeF6] 3-的几何构型为正八面体形。 [FeF6] 3- 3d 4s 4p 4d sp3 d 2 杂化 而当 Fe3+与 6 个 CN-结合为[Fe(CN)6] 3-时,由于配体 CN-的作用,导致 Fe3+的价 层电子结构重排,原有的 5 个未成对电子中有 4 个配成两对,空出的 2 个 3d 轨 道与 1 个 4s、3 个 4p 轨道组成 6 个 d 2 sp 3杂化轨道,接受 6 个 CN-中 C 原子提供 的 6 对孤对电子而形成 6 个配位键。所以[Fe(CN)6] 3-的几何构型为正八面体形。 [Fe(CN)6] 3- 3d 4s 4p d 2 sp 3 杂化 (2) 配合物中配位键的类型 形成体杂化轨道类型不仅决定配位个体的几何构型,而且决定其配位键的类 型[陶布(H.Taube)提出分为内轨和外轨配键]。若形成体全以最外层轨道(ns, np

d)杂化成键的,所成的配键称为外轨配键,对应的配合物称为外轨型配合物, 如FeF、NiNH)a2+等。若形成体还使用了次外层轨道[(m-I)d,s,p杂化成 键的,所成的配键称为内轨配键,对应的配合物称为内轨型配合物 ,如 [Fe(CN)6] 、[CoNH6*等。 配合物是内轨型还是外轨型与中心离子(电子构型、电荷)配位原子的性质(电 负性有关。 配合物是内轨型还是外轨型,主要取决于中心离子的电子构型,离子所带的 电荷和配位原子的电负性 只能用外层轨道形成外轨型配合物: 具有d构型的离子如Ni2+,Pt2+,P2+等,在大多数情况下形成内轨型配 合物: 具有d产d构型的离子,概可形成内轨型,也可形成外轨型配合物。 中心离子的电荷增多有利于形成内轨型配合物。因为中心离子的电荷较多 时,它对配位原 的孤电子对引力增 ,利于以其内层d轨道参与成键。例如 [CoNH)为外轨型,而[CoNH%为内轨型。 电负性大的原子如F,O等,与电负性较小的C原子比较,通常不易提供孤 电子对,它们作为配位原子时,中心离子以外层轨道与之成键,因而形成外轨型 配合物。C原子作为配位原子时(如在CN中)则常形成内轨型配合物。 2.配合物的稳定性、磁性与键型的关系 由前面讨论可知,以spd或sp杂化轨道成键的配合物为外轨型,而以 (m-1)d2sp3或(m-1)dsp2杂化轨道成键的配合物为内轨型。对于相同中心离子,由 于sp2d2杂化轨道能量比(n-1)d2sp3杂化轨道能量高,sp3杂化轨道能量比(n-1)dsp 杂化轨道能量高,当形成相同配位数的配离子时,如FeF子和Fe(CN): NiNH)4+和Ni(CNP其稳定性是不同的 一般内轨型比外轨型稳定 价键理论不 力地说可 了面 合物的儿何构型和某些化学性质,而且也能根 据配合物中未成对电子数的多少较好地解释配合物的磁性 物质的磁性与组成物质的原子、分子或离子中电子自旋运动有关。如果物质 中正自旋电子数和反自旋电子数相等(即电子皆己成对),电子自旋所产生的藏效 应相互抵消,该物质就表现为反磁性。而当物质中正、反自旋电子数不等时(即 有成单电子 总磁效应不能互相抵消, 整个原子或分子就具有顺磁性。所以 物质的磁性强弱(用磁矩4表示 质内部未成对的电子数多少有关。根据 学理论,“与未成对电子数(n)之间存在如下关系: u=Va0+2) (磁矩的单位为波尔磁子,单位符号为BM) 据上式可估算出未成对电子数n=一5的”理论值。反之,测定配合物的 磁矩 可以了解中心离 对电 以 该配合物的磁性(>0 的具有顺磁性,0的具有反磁性),以及是内轨型还是外轨型的。 例如e中有5个未成对d电子,根据u理=a+习可估算出Fe的磁 矩理论值为: 4理=5+百=5.92B.M 实验测得[FeF6的磁矩为5.90(B.M),由表8-5可知,在FeF6中,Fe仍 保留有5个未成对电子,以sp32杂化轨道与配位原子(F)形成外轨配键,则
nd )杂化成键的,所成的配键称为外轨配键,对应的配合物称为外轨型配合物, 如[FeF6] 3-、[Ni(NH3)4] 2+等。若形成体还使用了次外层轨道[(n-1)d, ns, np]杂化成 键的,所成的配键称为内轨配键,对应的配合物称为内轨型配合物,如 [Fe(CN)6] 3-、[Co(NH3)6] 3+等。 配合物是内轨型还是外轨型与中心离子(电子构型、电荷)配位原子的性质(电 负性)有关。 配合物是内轨型还是外轨型,主要取决于中心离子的电子构型,离子所带的 电荷和配位原子的电负性大小。 具有 d 10 构型的离子,只能用外层轨道形成外轨型配合物; 具有 d 8构型的离子如 Ni2+,Pt2+,Pd2+等,在大多数情况下形成内轨型配 合物; 具有 d 4~d 7 构型的离子,既可形成内轨型,也可形成外轨型配合物。 中心离子的电荷增多有利于形成内轨型配合物。因为中心离子的电荷较多 时,它对配位原子的孤电子对引力增强,利于以其内层 d 轨道参与成键。例如 [Co(NH3)6] 2+为外轨型,而[Co(NH3)6] 3+为内轨型。 电负性大的原子如 F,O 等,与电负性较小的 C 原子比较,通常不易提供孤 电子对,它们作为配位原子时,中心离子以外层轨道与之成键,因而形成外轨型 配合物。C 原子作为配位原子时(如在 CN-中)则常形成内轨型配合物。 2. 配合物的稳定性、磁性与键型的关系 由前面讨论可知,以 sp 3 d 2或 sp 3杂化轨道成键的配合物为外轨型,而以 (n-1)d2 sp3或(n-1)dsp2杂化轨道成键的配合物为内轨型。对于相同中心离子,由 于 sp3 d 2杂化轨道能量比(n-1)d2 sp3杂化轨道能量高,sp3杂化轨道能量比(n-1)dsp2 杂化轨道能量高,当形成相同配位数的配离子时,如[FeF6] 3-和[Fe(CN)6] 3-; [Ni(NH3)4] 2+ 和[Ni(CN)4] 2-其稳定性是不同的,一般内轨型比外轨型稳定。 价键理论不仅成功地说明了配合物的几何构型和某些化学性质,而且也能根 据配合物中未成对电子数的多少较好地解释配合物的磁性。 物质的磁性与组成物质的原子、分子或离子中电子自旋运动有关。如果物质 中正自旋电子数和反自旋电子数相等(即电子皆已成对),电子自旋所产生的磁效 应相互抵消,该物质就表现为反磁性。而当物质中正、反自旋电子数不等时(即 有成单电子),总磁效应不能互相抵消,整个原子或分子就具有顺磁性。所以, 物质的磁性强弱(用磁矩 μ表示)与物质内部未成对的电子数多少有关。根据磁 学理论,μ与未成对电子数(n)之间存在如下关系: μ= (磁矩的单位为波尔磁子,单位符号为 B.M.) 根据上式可估算出未成对电子数 n =1~5 的 μ理论值。反之,测定配合物的 磁矩,也可以了解中心离子未成对电子数,从而可以确定该配合物的磁性(μ>0 的具有顺磁性,μ=0 的具有反磁性),以及是内轨型还是外轨型的。 例如 Fe3+中有 5 个未成对 d 电子,根据 μ理= 可估算出 Fe3+的磁 矩理论值为: μ理= = 5.92(B.M.) 实验测得[FeF6] 3-的磁矩为 5.90(B.M.),由表 8-5 可知,在[FeF6] 3-中,Fe3+仍 保留有 5 个未成对电子, 以 sp3d2 杂化轨道与配位原子(F)形成外轨配键,则