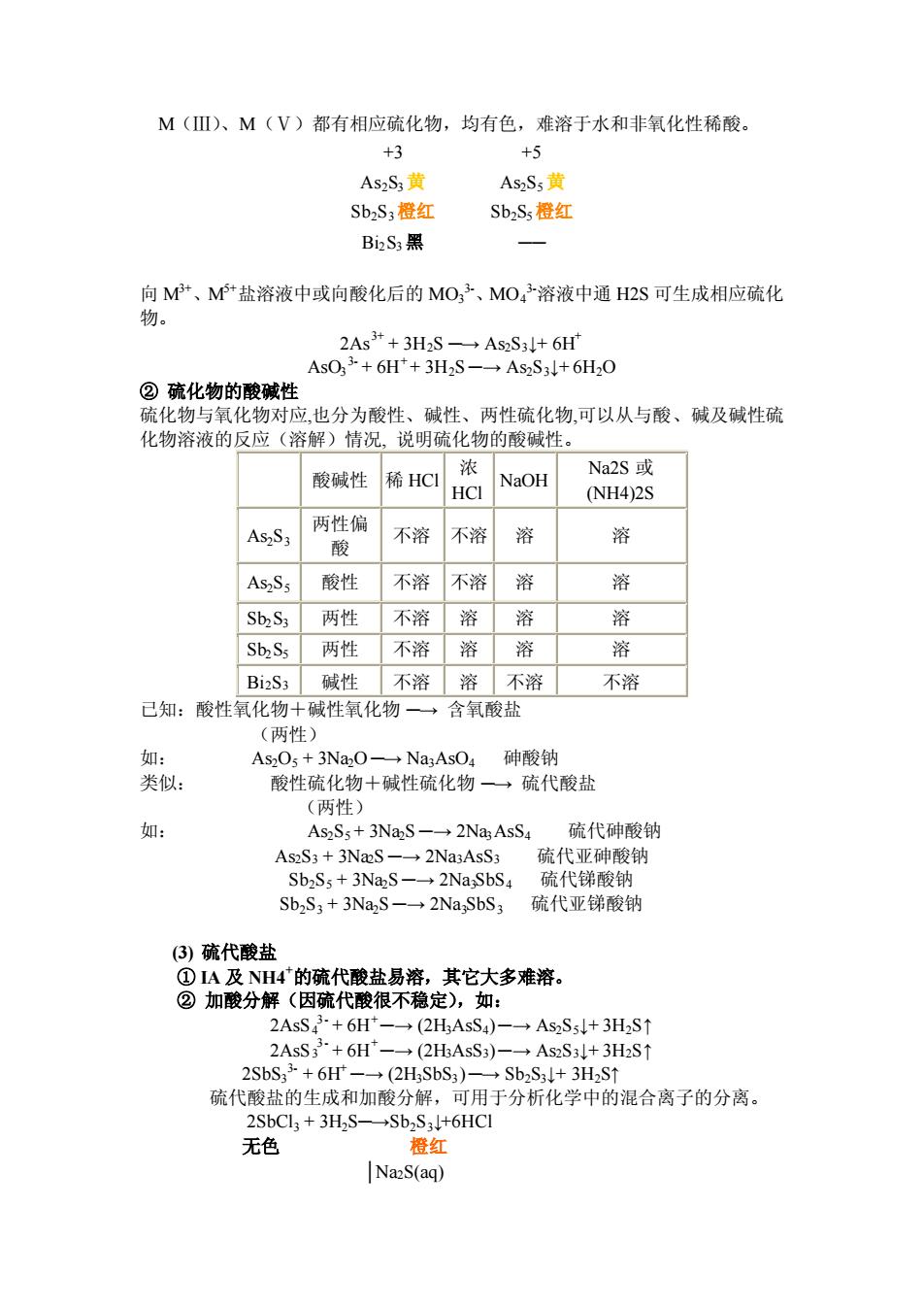
M(Ⅲ)、M(V)都有相应硫化物,均有色,难溶于水和非氧化性稀酸。 +3 +5 As2S黄 AsS5黄 SbzS,橙红 Sb2S,橙红 BiS黑 向M、M盐溶液中或向酸化后的MO子、MO子溶液中通H2S可生成相应硫化 2As"+3H2S As2S:+6H' AsO3+6H*+3H2S-As2S3+6H2O ②硫化物的酸碱性 硫化物与氧化物对应,也分为酸性、碱性、两性硫化物,可以从与酸、碱及碱性硫 化物溶液的反应(溶解)情况,说明硫化物的酸碱性。 酸碱性 浓NaOH 稀HCI HCI Na2S成 (NH4)2S 两性偏 不溶 酸 不溶 溶 带 酸性 不溶 不溶 溶 溶 SbS,两性 不溶溶溶 溶 Sb,S两性不溶溶溶 溶 Bi2S3 不溶 不溶 不溶 已知:酸性氧化物十碱性氧化物一含氧酸盐 (两性) 如: AsO+3NaO-NaAsO 砷酸钠 类似 酸性硫化物+碱性硫化物 →硫代酸盐 (两性) 如: AsSs+3NaS-→2 NasAsS 硫代砷酸钠 As2S3+3NaS-2Na3AsS3 硫代亚砷酸钠 SbSs+3NaS-→2 Na-SbS4 硫代锑酸钠 Sb2S3+3NazS-2Na SbS3 硫代亚递酸钠 (③)疏代酸盐 ①IA及NH4的硫代酸盐易溶,其它大多准溶。 ②加酸分解(因硫代酸很不稳定),如: 2AsS·+6H-→(2H,AsS4)-一AsS5J+3HS1 2AsS+6H-→(2HAsS) +6H (2H:SbS:) Sb2S:1+3H2S 硫代酸盐的生成和加酸分解,可用于分析化学中的混合离子的分离。 2SbCl3+3H2S-Sb2S31+6HCI 无色 箱红 NaS(aq)
M(Ⅲ)、M(Ⅴ)都有相应硫化物,均有色,难溶于水和非氧化性稀酸。 +3 +5 As2S3黄 As2S5黄 Sb2S3橙红 Sb2S5橙红 Bi2S3黑 ── 向 M3+、M5+盐溶液中或向酸化后的 MO3 3-、MO4 3-溶液中通 H2S 可生成相应硫化 物。 2As3+ + 3H2S ─→ As2S3↓+ 6H + AsO3 3- + 6H+ + 3H2S ─→ As2S3↓+ 6H2O ② 硫化物的酸碱性 硫化物与氧化物对应,也分为酸性、碱性、两性硫化物,可以从与酸、碱及碱性硫 化物溶液的反应(溶解)情况, 说明硫化物的酸碱性。 - 酸碱性 稀 HCl 浓 HCl NaOH Na2S 或 (NH4)2S As2S3 两性偏 酸 不溶 不溶 溶 溶 As2S5 酸性 不溶 不溶 溶 溶 Sb2S3 两性 不溶 溶 溶 溶 Sb2S5 两性 不溶 溶 溶 溶 Bi2S3 碱性 不溶 溶 不溶 不溶 已知:酸性氧化物+碱性氧化物 ─→ 含氧酸盐 (两性) 如: As2O5 + 3Na2O ─→ Na3AsO4 砷酸钠 类似: 酸性硫化物+碱性硫化物 ─→ 硫代酸盐 (两性) 如: As2S5 + 3Na2S ─→ 2Na3AsS4 硫代砷酸钠 As2S3 + 3Na2S ─→ 2Na3AsS3 硫代亚砷酸钠 Sb2S5 + 3Na2S ─→ 2Na3SbS4 硫代锑酸钠 Sb2S3 + 3Na2S ─→ 2Na3SbS3 硫代亚锑酸钠 (3) 硫代酸盐 ① IA 及 NH4+的硫代酸盐易溶,其它大多难溶。 ② 加酸分解(因硫代酸很不稳定),如: 2AsS4 3- + 6H+─→ (2H3AsS4) ─→ As2S5↓+ 3H2S↑ 2AsS3 3- + 6H+─→ (2H3AsS3) ─→ As2S3↓+ 3H2S↑ 2SbS3 3- + 6H + ─→ (2H3SbS3) ─→ Sb2S3↓+ 3H2S↑ 硫代酸盐的生成和加酸分解,可用于分析化学中的混合离子的分离。 2SbCl3 + 3H2S─→ Sb2S3↓+6HCl 无色 橙红 │Na2S(aq)

-→溶解为无色溶液(SbS,3) →Sb2S3l+S 11-2碳族元素 11-2-1碳族元素概述 Si Ge Pb ns'np 主要氧化值 0、+2、+4 且从C 一Pb +2氧化态稳定性↑ +4氧化态稳定性 ns2稳定性↑ 惰性电子对效应 碳广泛存在于生物界,动植物机体是多种含碳的有机化合物。 碳的主要同素异形体有金刚石、石墨、富勒烯。无定形炭如木炭、焦炭实际 为石墨的微晶。富勒烯是1985年发现的碳的第三种晶体形态。有C,、C0、C 它是由0 C60、C6 等。其中C60这一碳原子簇比较稳定 碳原子 组成的,具有32面体的空心球结构。 硅广泛存在于刊矿物界,主要以硅酸盐矿和石英矿存在。硅有晶体和无定形两 种,高纯硅单晶体是最重要的半导体材料。 锗是分散稀有元素,晶态锗也是重要的半导体材料。 锡、铅是用得较早、较广泛的金属元素。锡有三种同素异形体:灰锡、白锡、 脆锡 122-2碳的重要化合物 1.碳酸 (1)HCO3是二元弱酸 通常所用蒸馏水由于与空气接触,必溶有CO2而含H,CO,所以pH#7,而是 pH=6. (2)不稳定只存在于水溶液中。 在碳酸盐中加酸产生C02: CO3"+2H-(H2CO3) +CO2↑+HO L潭速西水→白色混浊(用于鉴定C0, (1)溶解性: 正盐:NH、IA(除L)盐易溶,其它难溶: 酸式盐:大多数易溶。 难溶碳酸盐:其相应酸式盐比正盐的溶解度大,如 C03+C02+H,0-→CaHC0h 难溶 可溶 易溶碳酸盐:其相应酸式盐比正盐溶解度小,如:
└───→ 溶解为无色溶液(SbS3 3- ) │HCl └─→ Sb2S3↓+ H2S 11-2 碳族元素 11-2-1 碳族元素概述 ⅣA 族元素 C Si Ge Sn Pb 价层电子构型 ns 2 np 3 主要氧化值 0、+2、+4 且从 C ───────→ Pb +2 氧化态稳定性↑ +4 氧化态稳定性↓ ∵ ns 2稳定性↑──惰性电子对效应 碳广泛存在于生物界,动植物机体是多种含碳的有机化合物。 碳的主要同素异形体有金刚石、石墨、富勒烯。无定形炭如木炭、焦炭实际 为石墨的微晶。富勒烯是 1985 年发现的碳的第三种晶体形态。有 C28、C30、C50、 C60、C76、C80、C90、C94、. . 、C240、C540 等。其中 C60 这一碳原子簇比较稳定。 它是由 60 个碳原子组成的,具有 32 面体的空心球结构。 硅广泛存在于矿物界,主要以硅酸盐矿和石英矿存在。硅有晶体和无定形两 种, 高纯硅单晶体是最重要的半导体材料。 锗是分散稀有元素,晶态锗也是重要的半导体材料。 锡、铅是用得较早、较广泛的金属元素。锡有三种同素异形体: 灰锡、白锡、 脆锡。 12-2-2 碳的重要化合物 1. 碳酸 (1) H2CO3是二元弱酸 通常所用蒸馏水由于与空气接触,必溶有 CO2而含 H2CO3,所以 pH≠ 7, 而是 pH≈6。 (2) 不稳定,只存在于水溶液中。 在碳酸盐中加酸产生 CO2: CO3 2- + 2H+ ─→ (H2CO3) ─→ CO2↑+ H2O 白色混浊(用于鉴定 CO3 2- ) (1) 溶解性: 正盐: NH4 +、IA(除 Li)盐易溶,其它难溶; 酸式盐: 大多数易溶。 难溶碳酸盐: 其相应酸式盐比正盐的溶解度大, 如: CaCO3 + CO2 + H2O ─→ Ca(HCO3)2 难溶 可溶 易溶碳酸盐: 其相应酸式盐比正盐溶解度小, 如: