
4M+O,+2H,O+8CN>4M(CN),]+40H M=Cu,Ag Au 4Cu+O,+2H,O+8NH3→ 4[CuNH,)2](无色)+4OH 02 [CuNH3)4]2+(蓝) 所以不可用铜器盛氨水。 2Ag+2H2S+02->2Ag2S+2H2O 银器年久变黑
M = Cu, Ag, Au [Cu(NH ) ] ( ) 2 3 4 + 蓝 所以不可用铜器盛氨水。 2Ag + 2H2 S+ O2 ⎯→2Ag2 S+ 2H2 O O2 银器年久变黑。 + − + + + + ⎯→ 4[Cu(NH ) ] ( ) 4OH 4Cu O 2H O 8NH 3 2 2 2 3 无色 − − − 4M +O2 + 2H2 O+8CN ⎯→4[M(CN)2 ] + 4OH
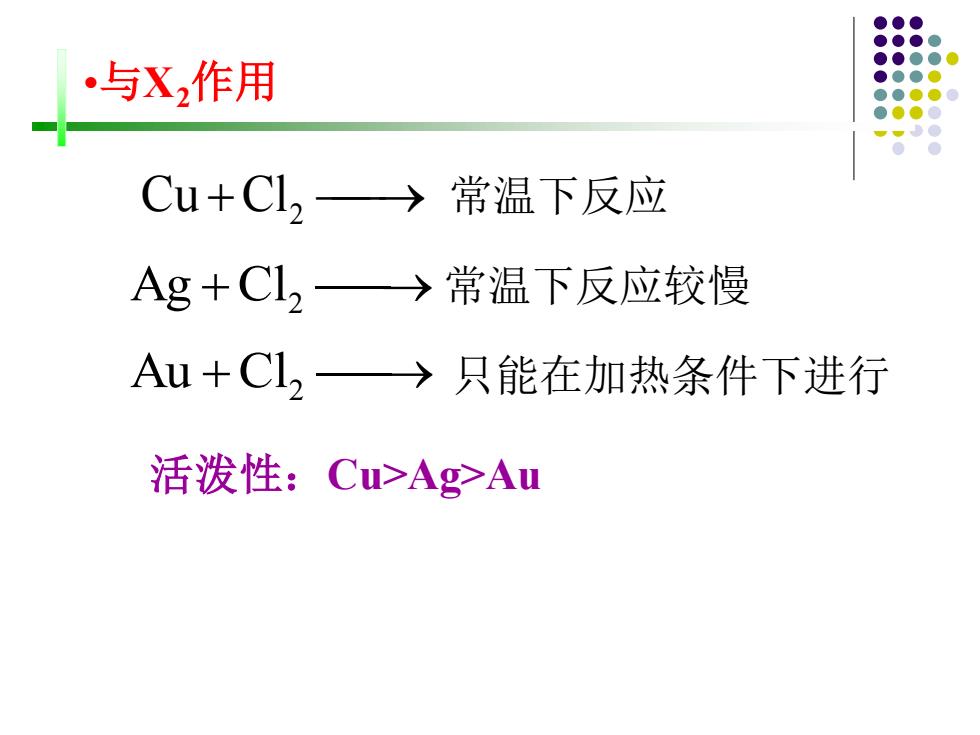
与X2作用 Cu+C12→常温下反应 Ag+Cl2→常温下反应较慢 Au+C2→只能在加热条件下进行 活泼性:Cu>Ag>Au
•与X2作用 Cu +Cl2 ⎯→ 常温下反应 活泼性:Cu>Ag>Au Au +Cl2 ⎯→ 只能在加热条件下进行 Ag +Cl2 ⎯→ 常温下反应较慢

·与酸作用 ①Cu,Ag,Au不能置换稀酸中的H(还原性差) (Cu有例外); ②生成难溶物或配合物,使单质还原能力增强; 2Ag+H2S->Ag2S(s)+H2(g) 2Ag+2H*+4I->2AgI2+H2(g) 2Cu+2H*+4CS(NH2 )2->2Cu[CS(NH2)2]2+H2(g) 硫脲 HCI
2Cu 2H 4CS(NH ) 2Cu[CS(NH ) ] H (g) 2Ag 2H 4I 2AgI H (g) 2Ag H S Ag S(s) H (g) 2 2 2 2 2 2 2 - 2 2 2 2 + + ⎯→ + + + ⎯→ + + ⎯→ + + + + − HCl 硫脲 •与酸作用 ①Cu,Ag,Au不能置换稀酸中的H+ (还原性差) (Cu有例外); ②生成难溶物或配合物,使单质还原能力增强;

③Cu,Ag,Au可溶于氧化性酸。 Cu+4HN0,(浓)→CuNO3)2+2N02+2H,0 Ag+2HNO,(浓)→AgNO3+NO2+HO Cu+2H2S04(浓)→CuS04+S02+2H20 2Ag+2H2S04(浓)→Ag2S04(S)+S02+2H20 Au+4HCI(浓)+HNO,(浓)→ 王水 H[AuCI]+NO(g)+2H,O
③ Cu,Ag,Au可溶于氧化性酸。 Cu + 4HNO3 (浓) ⎯→Cu(NO3 )2 + 2NO2 + 2H2 O H[AuCl ] NO(g) 2H O Au 4HCl( ) HNO ( ) 4 2 3 + + + 浓 + 浓 ⎯→ 2Ag + 2H2 SO4 (浓) ⎯→Ag2 SO4 (s) +SO2 + 2H2 O Cu + 2H2 SO4 (浓) ⎯→CuSO4 +SO2 + 2H2 O Ag + 2HNO3 (浓) ⎯→AgNO3 + N O2 + H2 O 王水

22-1-3铜族元素的重要化合物 铜的化合物 1.氧化态为+I的化合物 (1)氧化物 2ICuO4]2+CH,0。A Cu20(S)+C6H1207+2H20+40H 检验糖尿病:红色为有病,蓝色没有病
一、铜的化合物 22-1-3 铜族元素的重要化合物 1.氧化态为+Ⅰ的化合物 (1)氧化物 − − + + + ⎯⎯→ + Cu O(s) C H O 2H O 4OH 2[Cu(OH) ] C H O 2 6 1 2 7 2 6 1 2 6 2 4 检验糖尿病:红色为有病,蓝色没有病