
第十五章 氮族元素 §15-1氮族元素的通性 ·§15-2氮和它的化合物 ● §15-3磷和它的化合物 。§15-4砷、锑、秘
第十五章 氮族元素 ⚫ §15-1 氮族元素的通性 ⚫ §15-2 氮和它的化合物 ⚫ §15-3 磷和它的化合物 ⚫ §15-4 砷、锑、铋
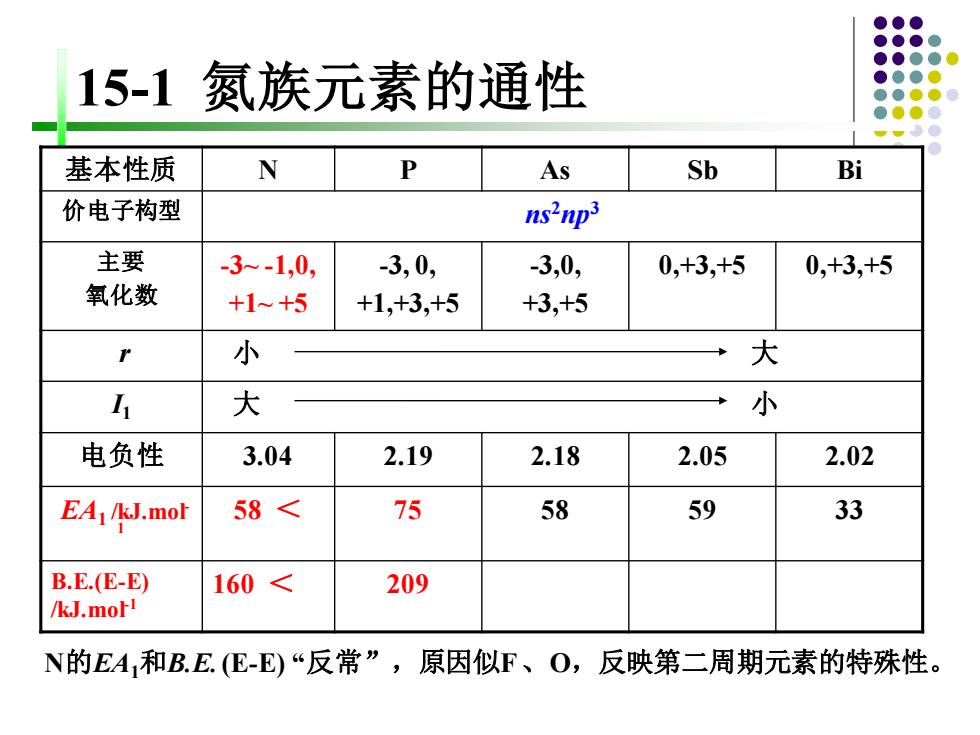
15-1氮族元素的通性 基本性质 N As Sb Bi 价电子构型 ns2np3 主要 3-1,0, -3,0, 3,0, 0,+3,+5 0,+3,+5 氧化数 +1~+5 +1,+3,+5 +3,+5 小 大 I 大 小 电负性 3.04 2.19 2.18 2.05 2.02 EA1/kJ.mot 58< 75 58 59 33 B.E.(E-E) 160< 209 /kJ.moF1 N的EA和B.E.(E-E)“反常”,原因似F、O,反映第二周期元素的特殊性
15-1 氮族元素的通性 基本性质 N P As Sb Bi 价电子构型 ns2np3 主要 氧化数 -3~ -1,0, +1~ +5 -3, 0, +1,+3,+5 -3,0, +3,+5 0,+3,+5 0,+3,+5 r 小 大 I1 大 小 电负性 3.04 2.19 2.18 2.05 2.02 EA1 /kJ.mol- 1 58 < 75 58 59 33 B.E.(E-E) /kJ.mol-1 160 < 209 N的EA1和B.E. (E-E) “反常”,原因似F 、O,反映第二周期元素的特殊性

P(四、As(四、Sb(⑩、Bi(四 稳定性增大 P(V)、As(V)、Sb(V)、Bi( 稳定性增大 第四、第六周期高价态不稳定、强氧化性。 (次周期性、6s2惰性电子对效应) -2 -2 +1 +1 N2H4 P2H4 N2O I H3P02 Li,N、Mg3N2、NaP遇水强烈水解成NH3、PH3
稳定性增大 第四、第六周期高价态不稳定、强氧化性。 (次周期性、6s2惰性电子对效应) -2 -2 +1 +1 N2H4 P2H4 N2O H3PO2 Li3N、Mg3N2、Na3P遇水强烈水解成NH3、PH3。 P(III)、 As (III)、 Sb (III)、 Bi (III) 稳定性增大 P(V)、As (V)、 Sb (V)、 Bi (V)
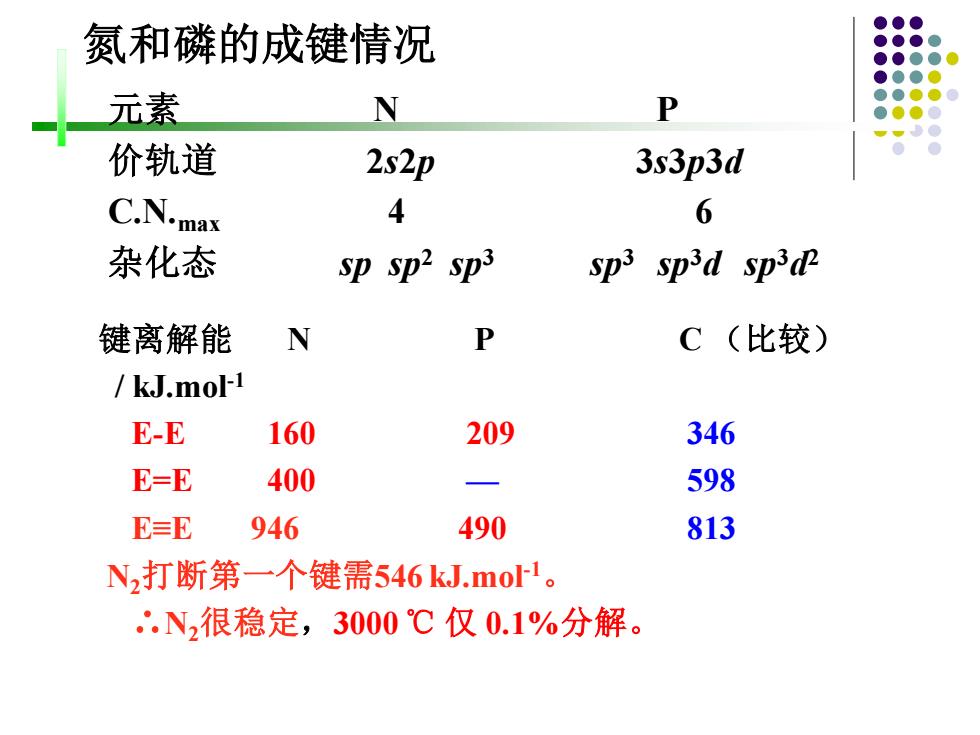
氮和磷的成键情况 元素 N P 价轨道 2s2p 3s3p3d C.N.max 4 6 杂化态 sp sp2 sp3 sp3 sped sp3d 键离解能 N P C(比较) /kJ.mol-1 E-E 160 209 346 E=E 400 一 598 E=E 946 490 813 N2打断第一个键需546kJ.mo1。 '.N,很稳定,3000℃仅0.1%分解
氮和磷的成键情况 元素 N P 价轨道 2s2p 3s3p3d C.N.max 4 6 杂化态 sp sp2 sp3 sp3 sp3d sp3d 2 键离解能 N P C (比较) / kJ.mol-1 E-E 160 209 346 E=E 400 — 598 E≡E 946 490 813 N2打断第一个键需546 kJ.mol-1 。 ∴N2很稳定,3000 ℃ 仅 0.1%分解

15-2 氮和它的化合物 2-1、氮 1.物理性质 氮气是无色、无嗅、无味的气体。微溶于水。m.p.63K, b.p.77K,临界温度126K(高于此温度,单靠增大压力无法 使之液化)
15-2 氮和它的化合物 2-1、氮 1.物理性质 氮气是无色、无嗅、无味的气体。微溶于水。 m.p. 63 K, b.p. 77 K,临界温度126 K(高于此温度,单靠增大压力无法 使之液化)