
第章分子结构和 共价键理论 6.1路易斯理论 6.2价键理论 6.3杂化轨道理论 6.4价层电子对互斥理论 6.5分子轨道理论
第6章 分子结构和 共价键理论 6.1 路易斯理论 6.2 价键理论 6.3 杂化轨道理论 6.4 价层电子对互斥理论 6.5 分子轨道理论

化学键:分子或晶体中相邻原子(或离 子)之间强烈的吸引作用。 化学键种类:共价键、离子键、金属键。 共价键理论: Lewisi理论(1916年) 价键理论1927年,1930年) 杂化轨道理论(1931年) 价层电子对互斥理论1940年) 分子轨道理论(20世纪20年代末)
化学键:分子或晶体中相邻原子(或离 子)之间强烈的吸引作用。 共价键理论: Lewis理论(1916年) 价键理论(1927年, 1930年) 杂化轨道理论(1931年) 价层电子对互斥理论(1940年) 分子轨道理论(20世纪20年代末) 化学键种类:共价键、离子键、金属键
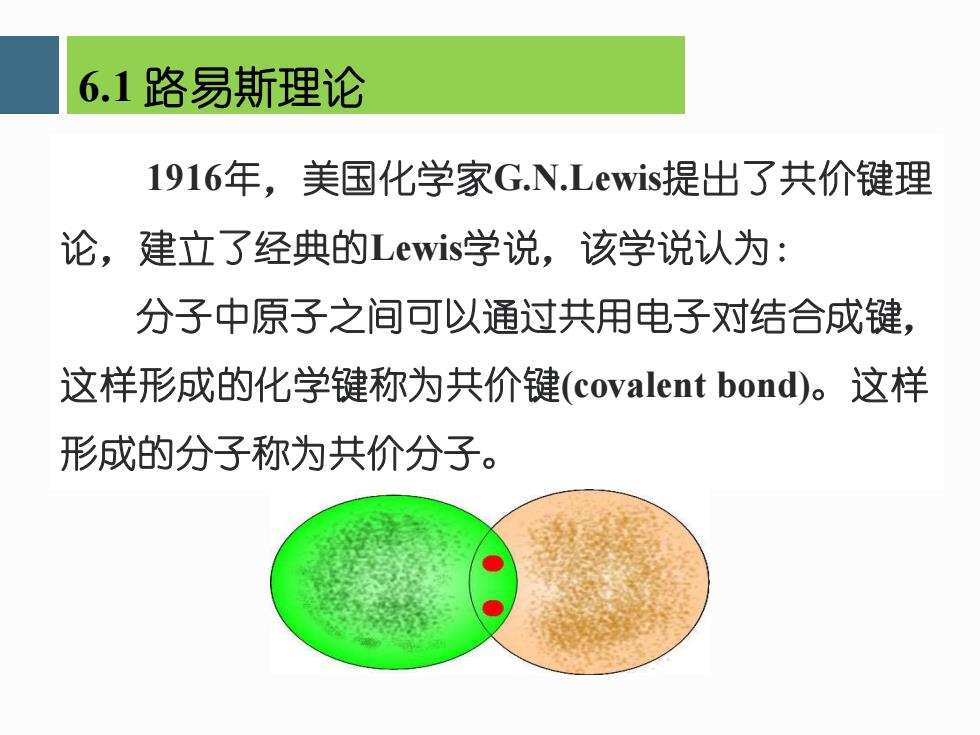
6.1路ù易斯理论 1916年,美国化学家G.N.Lewis提出了共价键理 论,建立了经典的Lewis学说,该学说认为: 分子中原子之间可以通过共用电子对结合成键, 这样形成的化学键称为共价键(covalent bond)。这样 形成的分子称为共价分子
1916年,美国化学家G.N.Lewis提出了共价键理 论,建立了经典的Lewis学说,该学说认为: 分子中原子之间可以通过共用电子对结合成键, 这样形成的化学键称为共价键(covalent bond)。这样 形成的分子称为共价分子。 6.1 路易斯理论
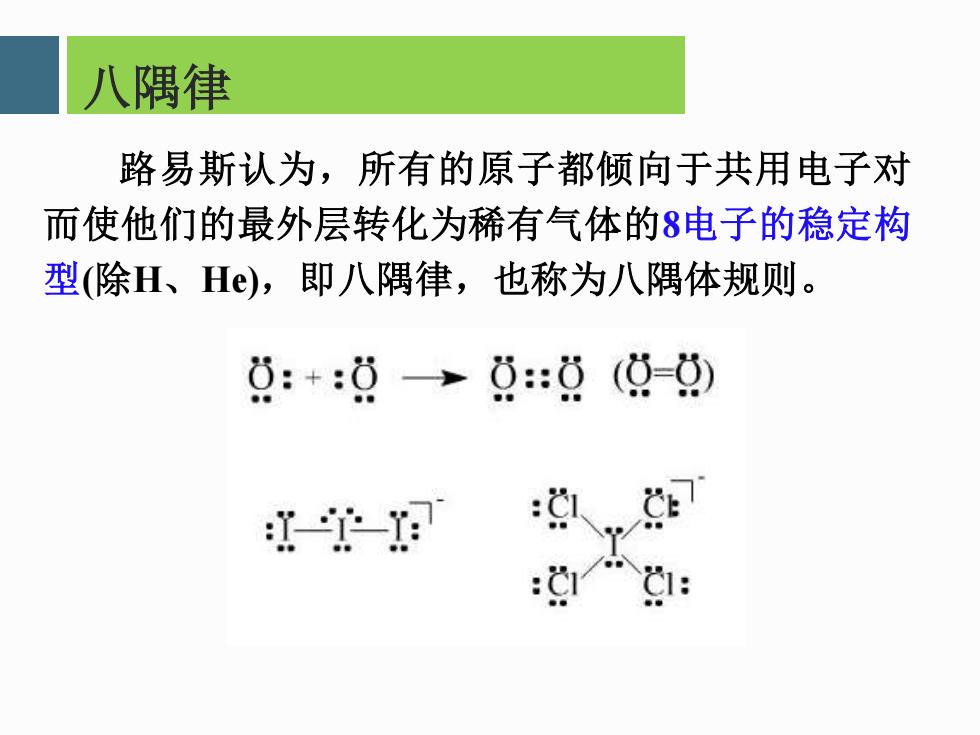
八隅律 路易斯认为,所有的原子都倾向于共用电子对 而使他们的最外层转化为稀有气体的8电子的稳定构 型(除H、H®),即八隅律,也称为八隅体规则。 0:+:0→0:0(9-0 - :1g1:
八隅律 路易斯认为,所有的原子都倾向于共用电子对 而使他们的最外层转化为稀有气体的8电子的稳定构 型(除H、He),即八隅律,也称为八隅体规则
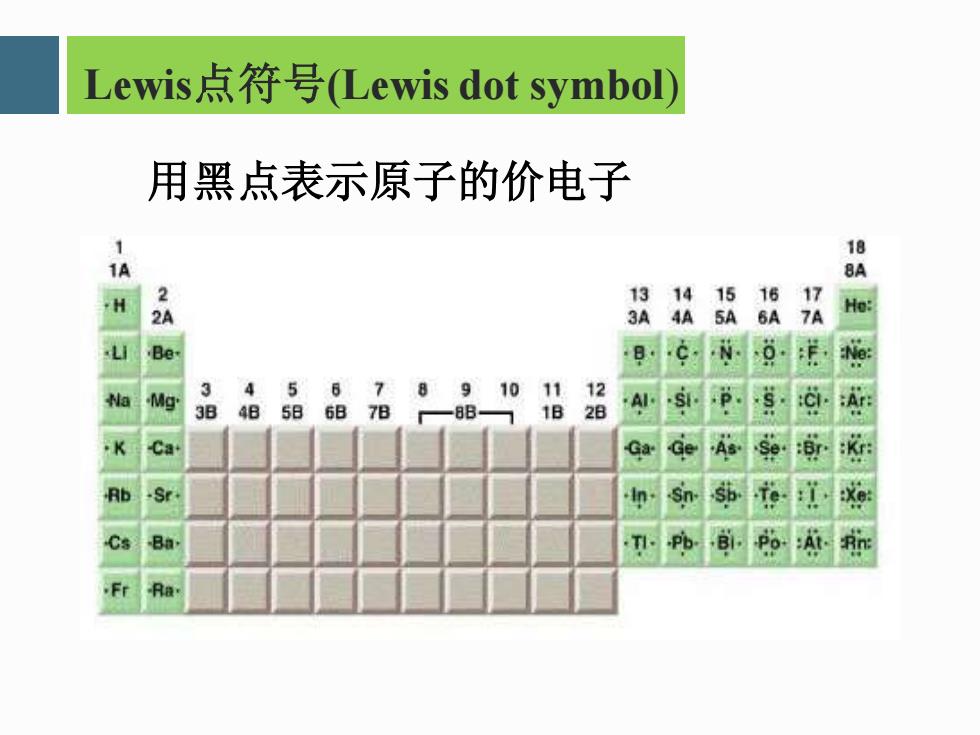
Lewis,点符号(Lewis dot symbol) 用黑点表示原子的价电子 18 1A 8 H 3A 4A He: 前 9 a 24 4 5 6 7 85 910 11 12 9 4 586B7B -88- 1B s K Ca Ga Ge Rb Sn. Cs Ba T .Fr Ra
Lewis点符号(Lewis dot symbol) 用黑点表示原子的价电子