
第十六章氧族元素 ·16-1氧族元素的通性 。16-2氧、臭氧 ·16-3水 ·16-4过氧化氢 ·16-5疏和它的化合物 ·16-6无机酸强度的变化规律
第十六章 氧族元素 ⚫ 16-1 氧族元素的通性 ⚫ 16-2 氧、臭氧 ⚫ 16-3 水 ⚫ 16-4 过氧化氢 ⚫ 16-5 硫和它的化合物 ⚫ 16-6 无机酸强度的变化规律
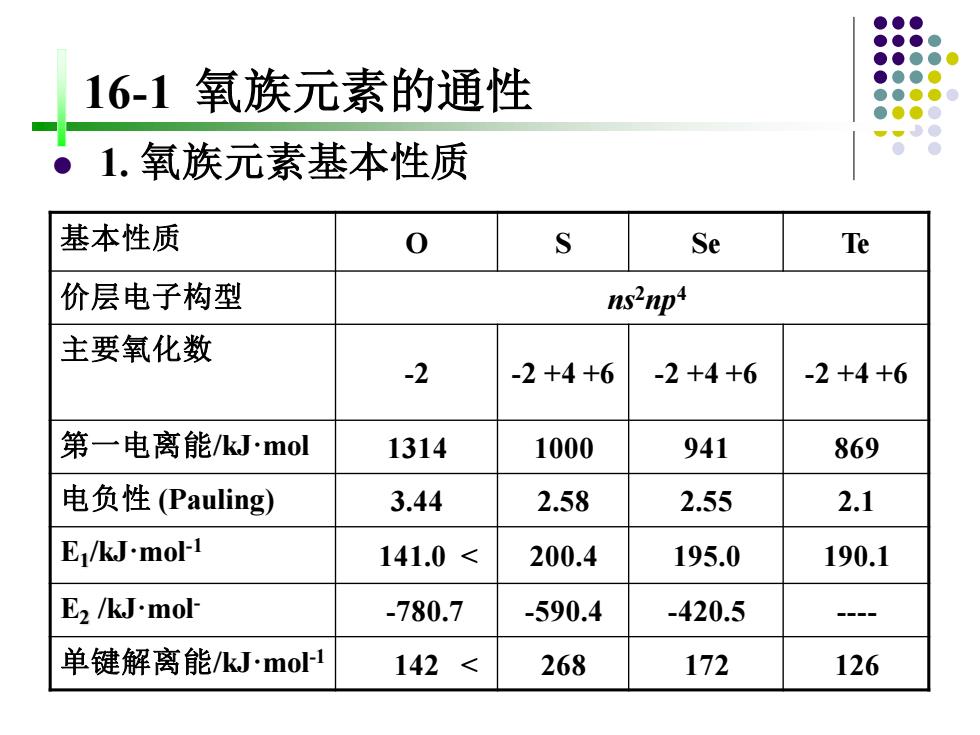
16-1氧族元素的通性 1.氧族元素基本性质 基本性质 0 S Se Te 价层电子构型 ns2np 主要氧化数 -2 -2+4+6 -2+4+6 -2+4+6 第一电离能kJ.mol 1314 1000 941 869 电负性(Pauling) 3.44 2.58 2.55 2.1 E/kJ-mol-1 141.0< 200.4 195.0 190.1 E2 /kJ.mol- -780.7 -590.4 -420.5 - 单键解离能/kJ.mol-1 142< 268 172 126
16-1 氧族元素的通性 ⚫ 1. 氧族元素基本性质 基本性质 O S Se Te 价层电子构型 ns2np4 主要氧化数 -2 -2 +4 +6 -2 +4 +6 -2 +4 +6 第一电离能/kJ·mol 1314 1000 941 869 电负性 (Pauling) 3.44 2.58 2.55 2.1 E1 /kJ·mol-1 141.0 < 200.4 195.0 190.1 E2 /kJ·mol- -780.7 -590.4 -420.5 - 单键解离能/kJ·mol-1 142 < 268 172 126
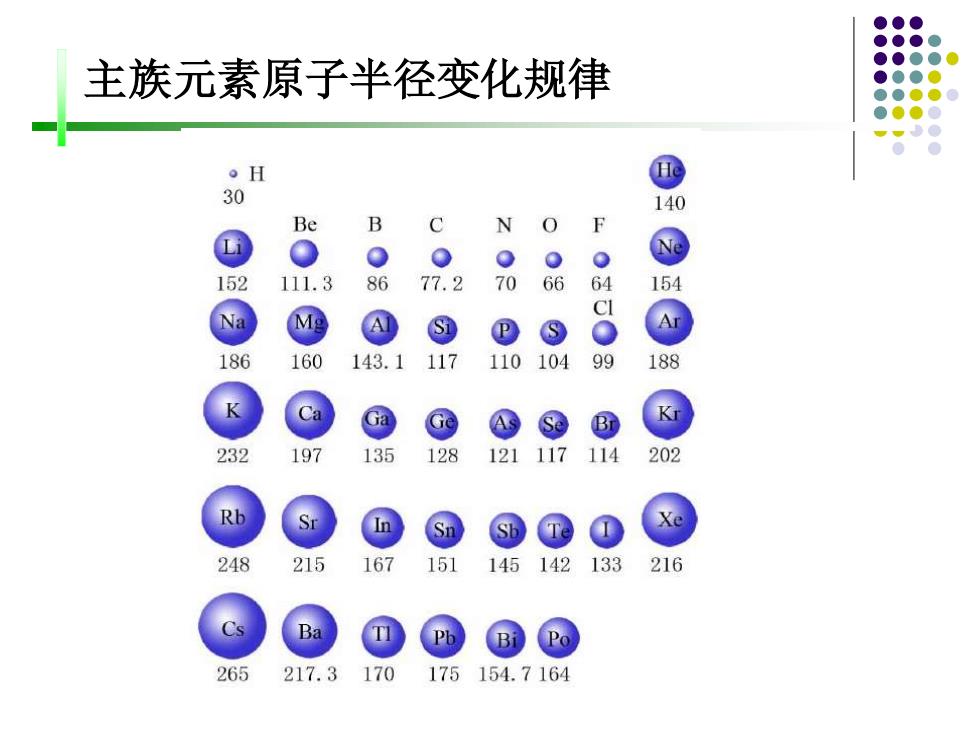
主族元素原子半径变化规律 。H 30 140 Be B C N 0 Li 0 152 111.3 86 77.2 70 66 64 154 CI Na D ⑧ 186 160 143.1 117 110 104 99 188 Ga Se B 232 197 135 128 121 117 114 202 248 215 167 151 145 142 133 216 265 217.3 170 175154.7164
主族元素原子半径变化规律

2.第二周期元素一氧的特殊性 1.氧化态:0基本为-2. 例外: -1 +1 +2 H202 02F2 OF2 2.E1:0<S 类似:F<CI 3.单键解离能 (1)自身成键 (E-E) O-0 S-S Se-Se Te-Te 142 264 172 kJ.mol-1
2. 第二周期元素—氧的特殊性 1. 氧化态:O基本为-2. 例外: -1 +1 +2 H2O2 O2F2 OF2 2. E1:O < S 类似 :F < Cl 3. 单键解离能 (1)自身成键(E-E) O-O < S-S > Se-Se > Te-Te 142 264 172 - kJ·mol-1

(2)与电负性较大、价电子数目较多的元素的原子成键 O-F S-F O-CI S-CI 190 326 205 255 kJ.mol-1 (3)与电负性较小、价电子数目较少的元素原子成键。 0-C(359)>S-C(272);0-H(467)>S-H374) 4.双键离解能 0=0(493.59kJmo1)>S=S(427.7kJmo1)
(2) 与电负性较大、价电子数目较多的元素的原子成键。 O-F < S-F O-Cl < S-Cl 190 326 205 255 kJ·mol-1 (3)与电负性较小、价电子数目较少的元素原子成键。 O-C (359 ) > S-C (272) ; O-H (467) > S-H(374) 4. 双键离解能 O=O (493.59 kJ·mol-1 ) > S=S (427.7 kJ·mol-1 )