
第6章络合滴定法 。6.1分析化学中的常见络合物 。6.2络合物的平衡常数 。6.3副反应系数和条件稳定常数 。6.4络合滴定法的基本原理 。6.5准确滴定与分别滴定判别式 。6.6络合滴定中酸度的控制 o6.7提高络合滴定选择性的途径 。6.8络合滴定的方式及应用
1 第6章 络合滴定法 6.1 分析化学中的常见络合物 6.2 络合物的平衡常数 6.3 副反应系数和条件稳定常数 6.4 络合滴定法的基本原理 6.5 准确滴定与分别滴定判别式 6.6 络合滴定中酸度的控制 6.7 提高络合滴定选择性的途径 6.8 络合滴定的方式及应用

概述 0络合滴定: 利用络合反应进行滴定分析的方法,称为配位滴定 法。 路易斯(Lewis.)酸碱反应 路易斯酸:凡能接受电子对的物质称之酸 (如金属阳离子Fe3+、Zn2+、A3+); 路易斯碱:凡能给出电子对的物质称之碱 (如含O、N、S、卤素等元素的物质)。 例如:用AgNO3溶液滴定氰化物
概述 络合滴定: 利用络合反应进行滴定分析的方法,称为配位滴定 法。 路易斯(Lewis)酸碱反应 路易斯酸:凡能接受电子对的物质称之酸 (如金属阳离子Fe3+、Zn2+、Al3+); 路易斯碱:凡能给出电子对的物质称之碱 (如含O、N、S、卤素等元素的物质)。 例如:用AgNO3溶液滴定氰化物 2

虽然配位反应很多,但并非都可用以进行配位滴定,只有 满足下列条件的配位反应,才能用于配位滴定。 。1.配位反应必须完全,即配合物有足够大的稳定常数; 。2.在一定反应条件下,只形成一种配位数的配合物; 。3.配位反应速度要快; 。4.有适当的方法确定反应的等量点。 3
虽然配位反应很多,但并非都可用以进行配位滴定,只有 满足下列条件的配位反应,才能用于配位滴定。 1.配位反应必须完全,即配合物有足够大的稳定常数; 2.在一定反应条件下,只形成一种配位数的配合物; 3.配位反应速度要快; 4.有适当的方法确定反应的等量点。 3

本章的重难点: 复杂体系的平衡处理方法—副反应系数和条件稳 定常数gK的计算。 本章学习要求: (1)掌握处理各种较复杂络合平衡体系的方法,并会计 算副反应系数α、条件稳定常数lgK'及各型体的问; (2)理解和掌握络合滴定原理,并能解决一般问题
本章的重难点: 复杂体系的平衡处理方法——副反应系数α和条件稳 定常数lgK’的计算。 本章学习要求: (1)掌握处理各种较复杂络合平衡体系的方法,并会计 算副反应系数α、条件稳定常数lgK’及各型体的[i] ; (2)理解和掌握络合滴定原理,并能解决一般问题。 4
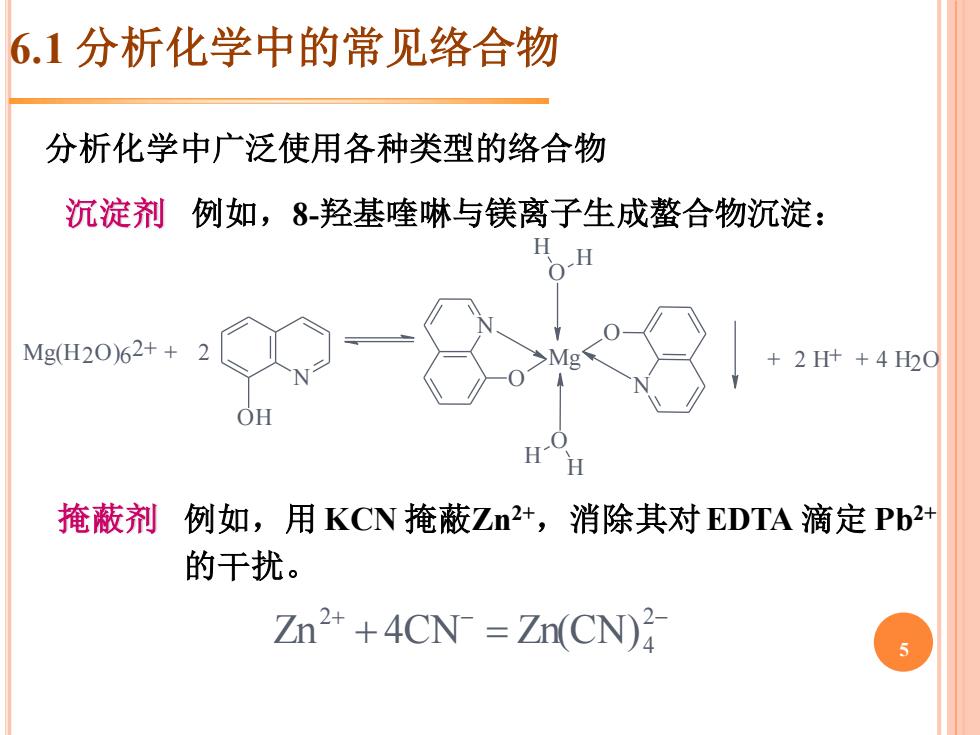
6.1分析化学中的常见络合物 分析化学中广泛使用各种类型的络合物 沉淀剂例如,8羟基喹啉与镁离子生成螯合物沉淀: Mg(H20)62++2 +2H++420 OH H 掩蔽剂 例如,用KCN掩蔽Zn2+,消除其对EDTA滴定Pb2+ 的干扰。 Zn2 +4CN Zn(CN)
沉淀剂 例如,8-羟基喹啉与镁离子生成螯合物沉淀: Mg(H2O )6 2+ + N O H 2 N O N O Mg O H H O H H + 2 H+ + 4 H2O 掩蔽剂 例如,用 KCN 掩蔽Zn2+,消除其对EDTA 滴定 Pb2+ 的干扰。 + − − + = 2 4 2 Zn 4CN Zn(CN) 分析化学中广泛使用各种类型的络合物 6.1 分析化学中的常见络合物 5