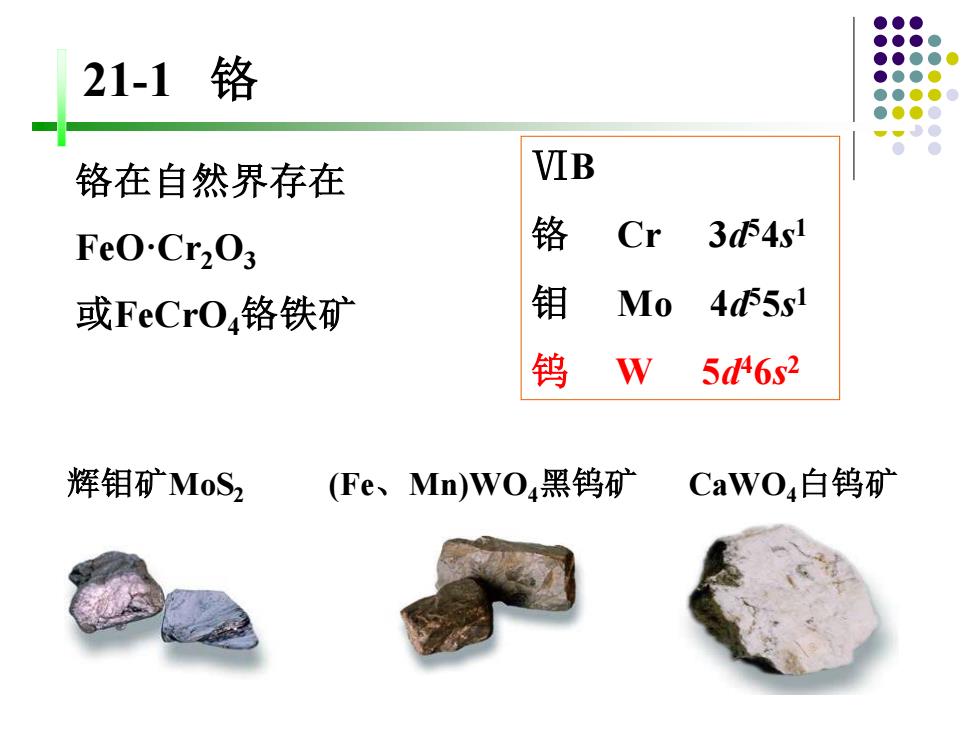
21-1铬 铬在自然界存在 VIB FeO.Cr2O3 铬 Cr 341 或FeCrO4铬铁矿 钼 Mo 455s1 钨 W 56s2 辉钼矿MoS2 (Fe、Mn)WO4黑钨矿 CaWO4白钨矿
ⅥB 铬 Cr 3d 54s 1 钼 Mo 4d 55s 1 钨 W 5d 46s 2 铬在自然界存在 FeO·Cr2O3 或FeCrO4铬铁矿 辉钼矿MoS2 (Fe、Mn)WO4黑钨矿 CaWO4白钨矿 21-1 铬
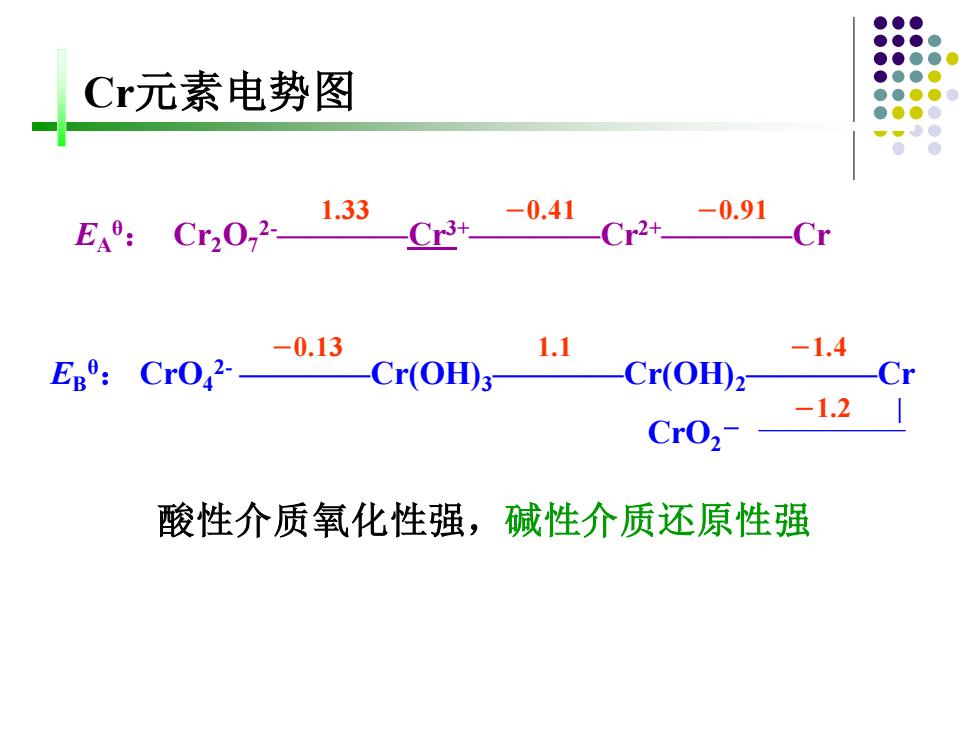
Cr元素电势图 EA9: Cr20,2 1.33 -0.41 Cr3+ Cr2+ -0.91 Cr Cr0,2.-0.13 1.1 -1.4 EBo: Cr(OH)3 Cr(OH)2- -Cr -1.2 CrO2- 酸性介质氧化性强,碱性介质还原性强
-0.13 1.1 -1.4 EB θ: CrO4 2- ————Cr(OH)3————Cr(OH)2————Cr -1.2 | CrO2 - ———————— 1.33 -0.41 -0.91 EA θ: Cr2O7 2-————Cr3+————Cr2+————Cr Cr元素电势图 酸性介质氧化性强,碱性介质还原性强

单质的性质 ①灰白色,熔点沸点高,硬度大。 ②活泼金属,表面己形成一层氧化膜,活泼性 下降。 ③无膜金属与酸的反应。 Cr+2H(稀)→Cr2+(蓝)+H2 02 Cr3+(紫) 2Cr+2H,SO4(浓)→Cr2(SO4)3+3SO2+H2O 在冷、浓硝酸中钝化
在冷、浓硝酸中钝化。 ③ 无膜金属与酸的反应。 ② 活泼金属,表面已形成一层氧化膜,活泼性 下降。 ① 灰白色, 熔点沸点高,硬度大。 Cr ( ) 2 3+ 紫 O 2Cr + 2H2 SO4 (浓) →Cr(2 SO4 )3 +3SO2 + H2 O 单质的性质
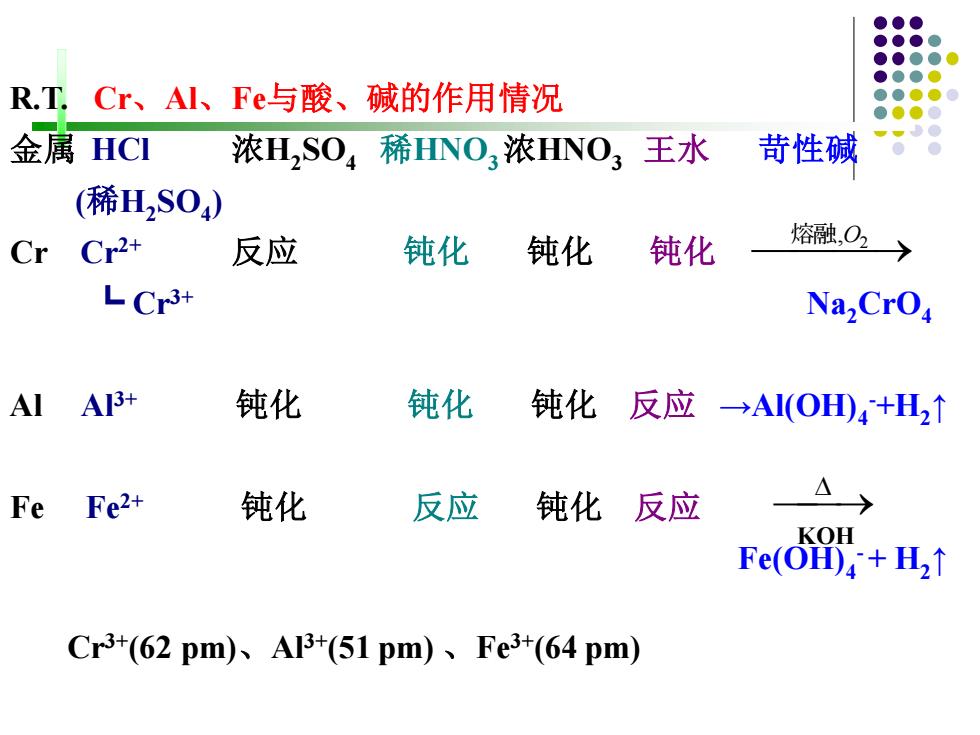
R.T. Cr、AI、Fe与酸、碱的作用情况 金属HCI 浓H,SO4稀HNO3浓HNO3王水 苛性碱 (稀HSO) Cr Cr2+ 反应 钝化 钝化 钝化 熔融,O2〉 L Cr3+ Na,CrO Al A3+ 钝化 钝化 钝化反应→AI(OHD)4+H2↑ Fe Fe2+ 钝化 反应 钝化 反应 KOH Fe(O,+H,↑ Cr3+(62pm)、Al3+(51pm)、Fe3+(64pm)
R.T. Cr、Al、Fe与酸、碱的作用情况 金属 HCl 浓H2 SO4 稀HNO3浓HNO3 王水 苛性碱 (稀H2 SO4 ) Cr Cr2+ 反应 钝化 钝化 钝化 ┗ Cr3+ Na2CrO4 Al Al3+ 钝化 钝化 钝化 反应 →Al(OH)4 -+H2 ↑ Fe Fe2+ 钝化 反应 钝化 反应 Fe(OH)4 -+ H2 ↑ ⎯熔融 ⎯⎯,O2 → ⎯⎯ → KOH Cr3+(62 pm)、Al3+(51 pm) 、Fe3+(64 pm)

C元素各氧化态物质的氧化还原性 Cr(IⅡ):Cr2+酸、碱介质均具有强还原性。 Cr2+→Cr3+ (酸性介质) Cr(OHD2→Cr(OH3→Cr042 (碱性介质) Cr(Ⅲ):Cr3+(酸性介质)Cr3+在酸介质中最稳定 CrO2、[Cr(OHD4](碱性介质) Cr(OHD3+氧化剂→CrO,2- Cr(ⅥI):Cr2O,2(酸性介质)强氧化性。 CrO42(碱性介质)
Cr(Ⅱ):Cr2+酸、碱介质均具有强还原性。 Cr2+ → Cr3+ (酸性介质) Cr(OH)2 → Cr(OH)3 → CrO4 2- (碱性介质) Cr(Ⅲ):Cr 3+(酸性介质) Cr3+在酸介质中最稳定 CrO2 -、[Cr(OH)4 - ] (碱性介质) Cr(OH)3 + 氧化剂 → CrO4 2- Cr(Ⅵ):Cr2O7 2-(酸性介质)强氧化性。 CrO4 2-(碱性介质) Cr元素各氧化态物质的氧化还原性