
5. 键型 多数氧化物为离子型,而硫化物、硒化物、碲化 物多数为共价型,仅IA、A化合物Na2S、BaS. 等为离子型。 6.配位数 中心原子周期 价轨道数 C.N.max 二 4 (2s2Px2py2p)4 H3O S 三 9 6 SF6
5.键型 多数氧化物为离子型,而硫化物、硒化物、碲化 物多数为共价型,仅IA、IIA化合物Na2S、BaS . 等为离子型。 6. 配位数 中心原子 周期 价轨道数 C.N.max O 二 4 (2s2px2py2pz ) 4 [H3O]+ S 三 9 6 SF6
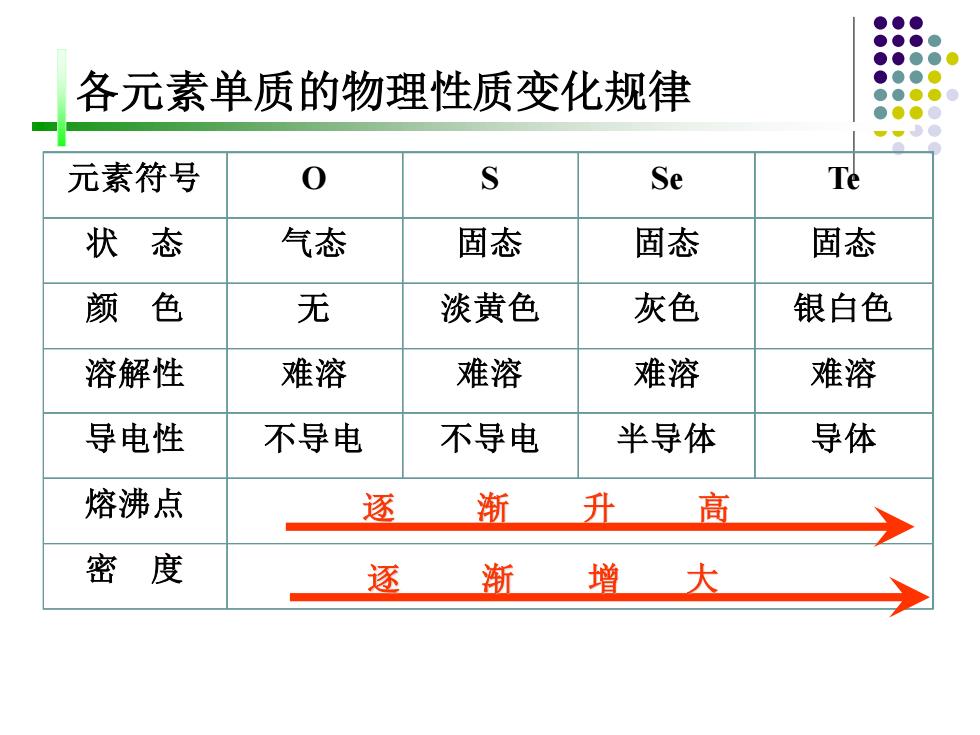
各元素单质的物理性质变化规律 元素符号 0 S Se Te 状态 气态 固态 固态 固态 颜色 无 淡黄色 灰色 银白色 溶解性 难溶 难溶 难溶 难溶 导电性 不导电 不导电 半导体 导体 熔沸点 逐渐 升高 密度 逐渐增大
各元素单质的物理性质变化规律 元素符号 O S Se Te 状 态 气态 固态 固态 固态 颜 色 无 淡黄色 灰色 银白色 溶解性 难溶 难溶 难溶 难溶 导电性 不导电 不导电 半导体 导体 熔沸点 密 度 逐 渐 升 高 逐 渐 增 大

16-2氧、臭氧 。2-1氧在自然界的分布 三种同位素示踪原子180,Ps70 ·2-2氧的制备和空气液化
16-2 氧、臭氧 ⚫ 2-1 氧在自然界的分布 三种同位素 示踪原子18O,P570 ⚫ 2-2 氧的制备和空气液化

2-3氧的结构、性质和用途 1. 氧分子形态0202022.02+022+ 02分子结构:VB法02s22p12p,12pz 02s22px12p,12pz2 即:0=0 似应为“逆磁”。 M0:02分子轨道式 uss斜 人寸〔2H2B.①8B.√T. 02分子成键: 1o+26 02分子顺磁
1. 氧分子形态 O2 O- 2 O2 2- O2 + O2 2+ ( 2)B.M. 2.83B.M. ( )( )( )( )( ) 1 ( 2 ) 2 1 2 2 2 2 2 2 2 2 2 2 2 2 1 2 1 + = nn px pz py pz py s s s s px = MO: O2分子轨道式 3 1+22 2-3 氧的结构、性质和用途 O2分子成键: O2分子结构:VB法 O 2s 2 2px 1 2py 1 2pz 2 | | O 2s 2 2px 1 2py 1 2pz 2 即: O=O 似应为“逆磁”。 O2分子顺磁

02022-02+022+ 3Aaa厚 ∠6②B.wB.Nat 人手季 L为2②B.©I 10 寸B.NB.4☑2 c6D元要
=( 2)B.M1.73B.M. O, :( )( )( )( )( ) 2 ( 2 ) 2 1 2 2 2 2 2 2 2 2 2 2 2 2 1 2 2 1 + = − nn MO px pz py pz py s s s s px =( 2)B.M0 O, :( )( )( )( )( ) 2 ( 2 ) 2 2 2 2 2 2 2 2 2 2 2 2 2 2 1 2 1 2 2 + = − nn MO px pz py pz py s s s s px =( 2)B.M1.73B.M. O, :( )( )( )( )( ) 1 ( 2 ) 2 0 2 2 2 2 2 2 2 2 2 2 2 2 1 2 1 + 2 + = nn MO px pz py pz py s s s s px =( 2)B.M0 O, :( )( )( )( )( ) 0 ( 2 ) 2 0 2 2 2 2 2 2 2 2 2 2 2 2 1 2 1 2+ 2 + = nn MO px pz py pz py s s s s px 1 3 1+2 3 2 2 1+12+1 2 1+22 O- 2 O2 2- O2 + O2 2+