
第五章酸碱平衡与酸碱滴定法 acid-base equilibrium and titration 5.1溶液中的酸碱反应与平衡 5.2酸碱组分平衡浓度与分布分数 5.3i 溶液中的H浓度计算 5.4 对数图解法 5.5酸碱缓冲溶液 5.6 酸碱指示剂 5.7酸碱滴定原理 5.8终点误差 5.9酸碱滴定法的应用 5.10非水溶液酸碱滴定简介
1 5.1 溶液中的酸碱反应与平衡 5.2 酸碱组分平衡浓度与分布分数 5.3 溶液中的H+浓度计算 5.4 对数图解法 5.5 酸碱缓冲溶液 5.6 酸碱指示剂 5.7 酸碱滴定原理 5.8 终点误差 5.9 酸碱滴定法的应用 5.10 非水溶液酸碱滴定简介 第五章 酸碱平衡与酸碱滴定法 (acid-base equilibrium and titration)

5.8 终点误差 终点误差:指示剂确定的滴定终点(p)与化学计量 点(sp)之间存在着差异(pH邦Hp),使滴定结果 产生的误差,用E表示。 滴定剂过量或不足的物质的量 E= ×100% 滴定剂需要的物质的量 g 加东理2大深 Analytical Chemistry 2
Analytical Chemistry 2 终点误差 终点误差:指示剂确定的滴定终点 (ep)与化学计量 点 (sp) 之间存在着差异(pHep≠pHsp) ,使滴定结果 产生的误差,用Et表示。 Et = 100% 滴定剂需要的物质的量 滴定剂过量或不足的物质的量
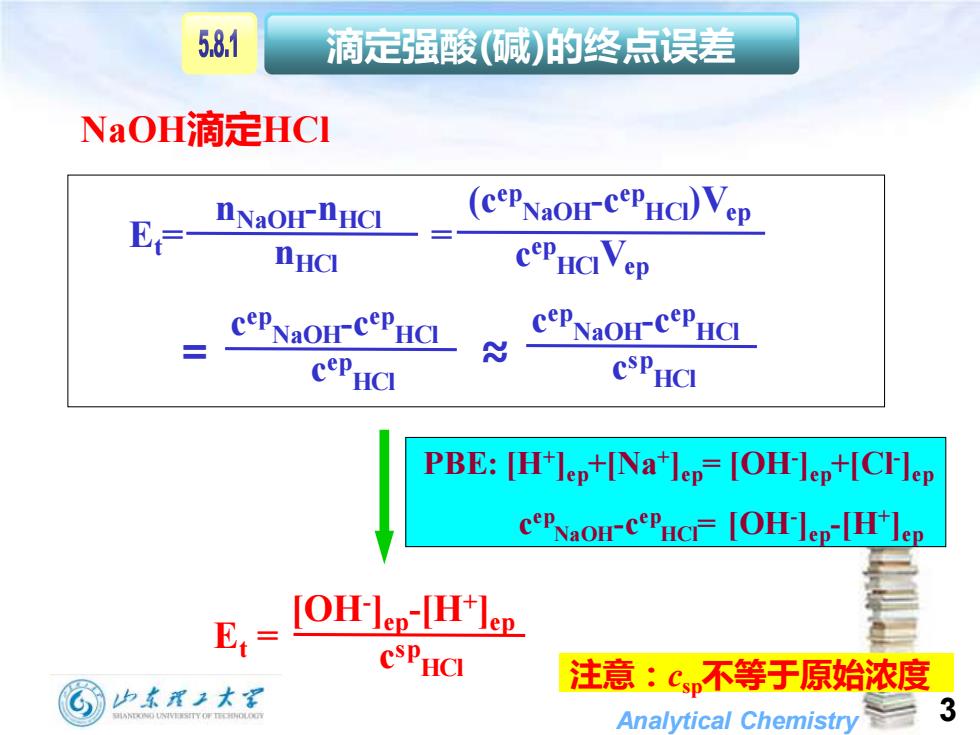
5,81 滴定强酸(碱)的终点误差 NaOH滴定HCI (cePNaoH-cePHCVep E=- DNaOH-DHCI_」 nHCI CePHCVep CPNOH CPHC cePNaoH-CePHC CePHCI CSPHCI PBE:[H+lep+[Na+lep=[OH-lep+[CFlep cePNaoH-cePHCI=[OH-]ep-[H]ep E,= [OH-lep-THJep CSPHCI 注意:cp不等于原始浓度 山东理王大军 Analytical Chemistry 3
Analytical Chemistry 3 滴定强酸(碱)的终点误差 PBE: [H+ ]ep+[Na+ ]ep= [OH- ]ep+[Cl- ]ep c ep NaOH-c ep HCl= [OH- ]ep-[H+ ]ep Et = [OH- ]ep-[H+ ]ep c sp HCl Et= = nNaOH-nHCl nHCl (cep NaOH-c ep HCl)Vep c ep HClVep c ep NaOH-c ep HCl c ep HCl c ep NaOH-c ep HCl c sp HCl = ≈ NaOH滴定HCl 注意:csp不等于原始浓度
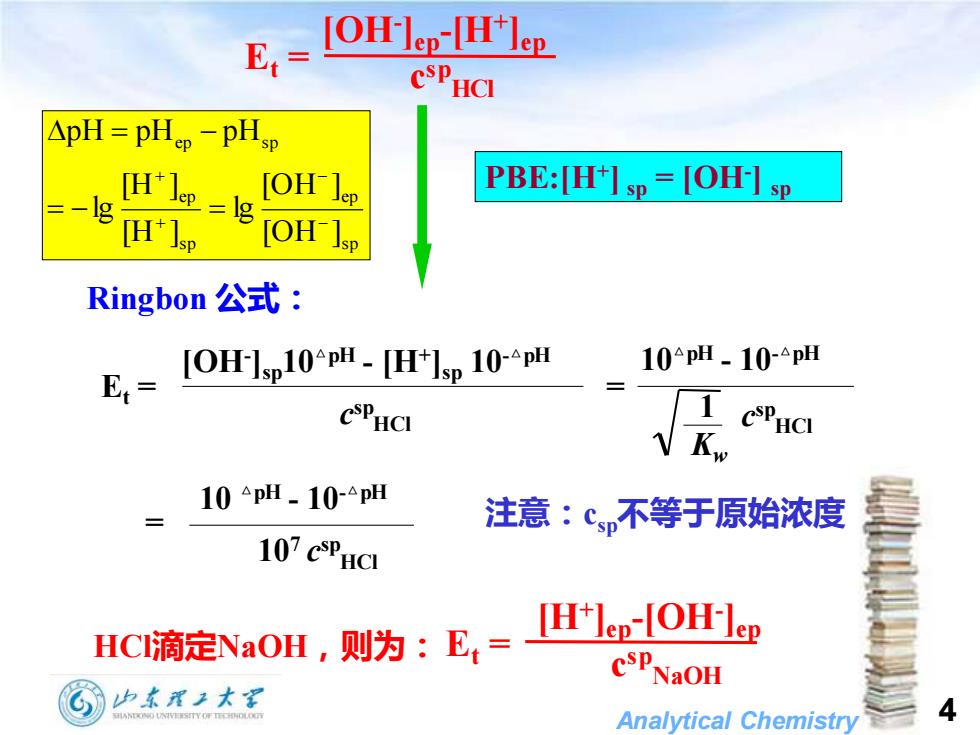
E= [OH-]ep-THlep CSPHCI △pH=pHp-pHsp PBE:[H+]sp=[OH-]sp =-8m1goH Ringbon公式: E-H1010 10pH.10-△pH CSPHCI 1 CSPHCI 10△pH-10-△pH 注意:c不等于原始浓度 107 CSPHCI HC滴定NaOH,则为:E,= [H+Jep-[OH-lep CSPNaOH 山东理王大军 Analytical Chemistry 4
Analytical Chemistry 4 Ringbon 公式: HCl滴定NaOH,则为: Et = [OH- ]ep-[H+ ]ep c sp HCl Et = [H+ ]ep-[OH- ]ep c sp NaOH 注意:csp不等于原始浓度 Et = = c sp HCl [OH- ]sp10△pH - [H+ ]sp 10-△pH Kw 1 c sp HCl 10△pH - 10-△pH 107 c sp HCl 10 △pH - 10-△pH = s p ep s p ep ep s p [OH ] [OH ] lg [H ] [H ] lg pH pH pH − − + + = − = = − PBE:[H+ ] sp = [OH- ] sp

例用0.1000mo/L的Na0H滴定30.00mL0.1mol/L的HC1, 求甲基橙和酚酞变色时的滴定误差。 [解]方法一 (1)MO变色pHp4.0 [H'Jep=10-40 [OH-Jep=10-10.0 E,=0H。-Hr12-100-10 -×100%=-0.2% CSPHCI 0.05 (2)PP.变色pHp-9.0 [H1ep-10-9,0[OH-lep=10-5.0 E,=105-109 ×100%=0.02% 0.05 少东理工大军 Analytical Chemistry 5
Analytical Chemistry 5 [解]方法一 (1)MO变色 pHep=4.0 [H+ ] ep=10-4.0 [OH - ] ep=10-10.0 (2)PP.变色 pHep=9.0 [H+ ] ep=10-9.0 [OH- ] ep=10-5.0 100% 0.2% 0.05 10 10 c [OH ] -[H ] E 1 0.0 -4.0 HCl s p ep ep - = − − = = + − t 100% 0.02% 0.05 10 10 E 5 -9 = − = − t 例 用0.1000mol/L的NaOH滴定30.00mL 0.1mol/L的HCl , 求甲基橙和酚酞变色时的滴定误差