
第七章 氧化还原滴定法 Oxidation-Reduction Titration 7.1氧化还原平衡 7.2氧化还原滴定原理 7.3氧化还原滴定的预处理 7.4常用的氧化还原滴定法 7.5氧化还原滴定结果的计算
1 7.1 氧化还原平衡 7.2 氧化还原滴定原理 7.3 氧化还原滴定的预处理 7.4 常用的氧化还原滴定法 7.5 氧化还原滴定结果的计算 第七章 氧化还原滴定法 (Oxidation-Reduction Titration)

7.4 氧化还原滴定的方法 高锰酸钾法 重铬酸钾法 碘量法 山东理工大军 Analytical Chemistry 2
Analytical Chemistry 2 高锰酸钾法 重铬酸钾法 碘量法 氧化还原滴定的方法

7.41 KMnO法 一、 概述 氧化能力 KMnO4,强氧化剂 还原产物 与plH有关 强酸性: Mn04+8Ht+5e=Mn2++4H20 E0=1.51y 微酸性、中性或弱碱性: Mn04+2H20+3e=Mn02+40H E0=0.59v NaOH浓度大于2moL1的碱性介质: Mn04+e=Mn042- E0=0.564V 加东理2大? Analytical Chemistry 3
Analytical Chemistry 3 一、概述 KMnO4,强氧化剂 氧化能力 还原产物 与pH有关 强酸性: MnO4 - + 8 H+ + 5e = Mn2+ + 4H2O Eө =1.51v 微酸性、中性或弱碱性: MnO4 - + 2H2O + 3e = MnO2 + 4OH- Eө =0.59v NaOH浓度大于2mol·L-1的碱性介质: MnO4 - + e = MnO4 2- Eө =0.564v KMnO4法
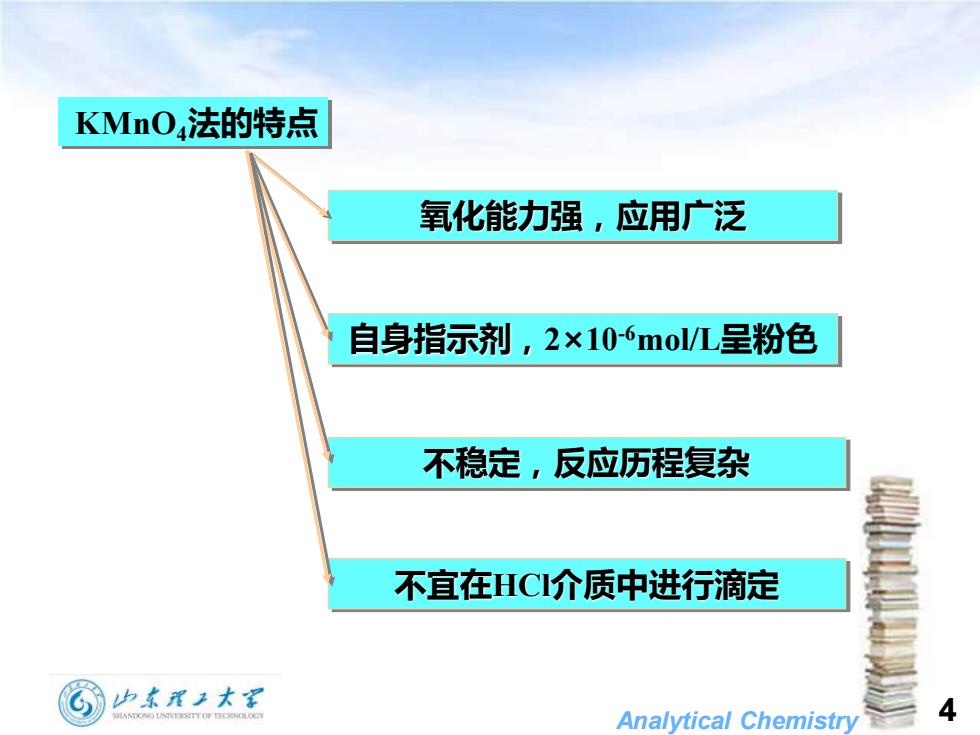
KMnO4法的特点 氧化能力强,应用广泛 自身指示剂,2×10-6mo/L呈粉色 不稳定,反应历程复杂 不宜在HC介质中进行滴定 少本理子大军 Analytical Chemistry 4
Analytical Chemistry 4 KMnO4法的特点 氧化能力强,应用广泛 自身指示剂,2×10-6mol/L呈粉色 不稳定,反应历程复杂 不宜在HCl介质中进行滴定
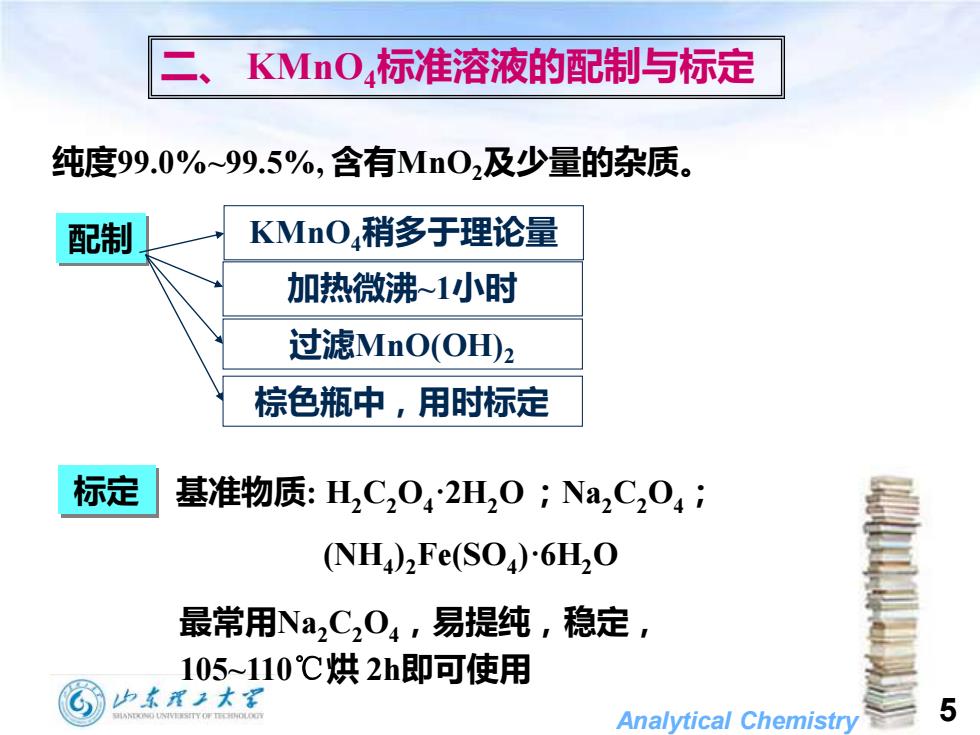
二、KMnO,标准溶液的配制与标定 纯度99.0%~99.5%,含有Mn0,及少量的杂质。 配制 KMnO,稍多于理论量 加热微沸~1小时 过滤MnO(OHD2 棕色瓶中,用时标定 标定 基准物质:H2C2042H20;Na2C204 (NH)Fe(SO)6HO 最常用Na,C,04,易提纯,稳定 105~110℃烘2h即可使用 加东理2大军 Analytical Chemistry 5
Analytical Chemistry 5 二、 KMnO4标准溶液的配制与标定 纯度99.0%~99.5%, 含有MnO2及少量的杂质。 标定 基准物质: H2C2O4·2H2O ;Na2C2O4; (NH4 ) 2Fe(SO4 )·6H2O 配制 棕色瓶中,用时标定 加热微沸~1小时 过滤MnO(OH)2 KMnO4稍多于理论量 最常用Na2C2O4,易提纯,稳定, 105~110℃烘 2h即可使用