
第六章配位滴定法 Complexmetric Titrations 6.1配位滴定中的滴定剂 6.2i 配位平衡常数 6.3副反应系数和条件稳定常数 6.4配位滴定法的基本原理 6.5准确滴定与分别滴定判别式 6.6配位滴定中酸度的控制 6.7提高配位滴定选择性的途径 6.8配位滴定方式及其应用
1 6.1 配位滴定中的滴定剂 6.2 配位平衡常数 6.3 副反应系数和条件稳定常数 6.4 配位滴定法的基本原理 6.5 准确滴定与分别滴定判别式 6.6 配位滴定中酸度的控制 6.7 提高配位滴定选择性的途径 6.8 配位滴定方式及其应用 第六章 配位滴定法 (Complexmetric Titrations)

6.6 配位滴定中的酸度控制 66.1 单一离子滴定的酸度控制 M+ Y MY 对单一离子的滴定: Ig K'My =Ig KMY -1gaM-1gdY(D) OH 1 IH M(OH)n HiY 山本理王大军 Analytical Chemistry 2
Analytical Chemistry 2 对单一离子的滴定: M + Y MY H + H Y - OH M(OH) n MY MY M Y(H) i lg ' lg lg lg K K = − − 单一离子滴定的酸度控制 配位滴定中的酸度控制

一、允许的最高酸度(最低H 准确滴定的要求g(C洲Kw)≥6 假设当Cp=0.01 得1gK'w≥6-gC=6+2=8 Ig K'My =1g KMY-IgaM-1gdYcD) 高酸度下lga忽略lgK'MY=Ig KMY-lgv IgdyoD =Ig KMy -IgK'MY lg &Y( =Ig KMY-8 查对应的pH值 pHL 加东理2大深 Analytical Chemistry 3
Analytical Chemistry 3 一、允许的最高酸度(最低pH) MY MY M Y(H) lg ' lg lg lg K K = − − 准确滴定的要求 lg( M ' MY ) 6 sp C K 假设当CM sp = 0.01 得 lg ' 6 − lg = 6 + 2 = 8 s p K M Y CM 高酸度下lg M 忽略 MY MY Y(H) lg ' lg lg K K = − Y(H) MY MY L MY lg lg lg ' lg 8 K K K = − = − Y(H) L lg 查对应的pH值 pHL

例:用0.02mol/L EDTA滴定20.00mL0.02mol/L的Fe3+溶 液,求pHL。 解 lgxy.=Ig KFeY-8=25.1-8=17.1 查p.394,表10 pH≈1.2 山本理王大军 Analytical Chemistry 4
Analytical Chemistry 4 例: 用0.02 mol/L EDTA滴定20.00 mL 0.02 mol/L 的Fe3+溶 液,求pHL。 解 查p.394, 表10 pHL 1.2 lg Y(H) = lg KFeY − 8 = 25.1− 8 = 17.1 L
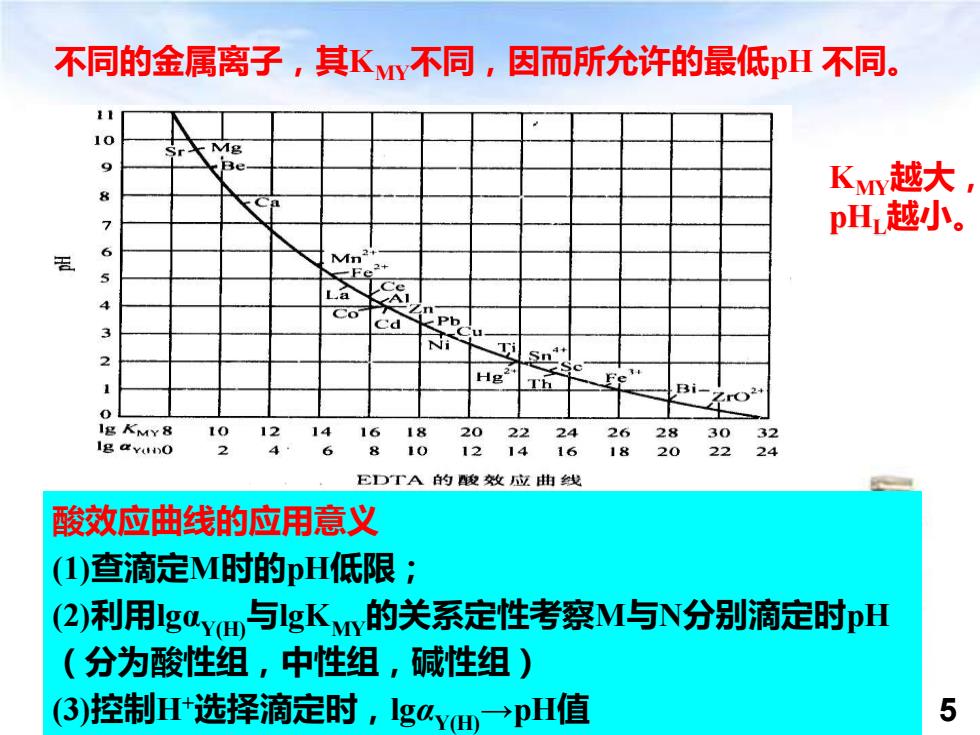
不同的金属离子,其Ky不同,因而所允许的最低H不同。 10 Kv越大, pH越小。 6 Mn2 Ee+ La Co <Pb 3 Ca Ti Sn Hg Th Fe 3i- r2 0 Ig KMY8 10 12 14 16 18 20 22 24 2628 3032 Ig avuno 2 4 8 10 12 14 16 1820 22 24 EDTA的酸效应曲线 酸效应曲线的应用意义 (I)查滴定M时的pH低限: (2)利用guvm与gKn的关系定性考察M与N分别滴定时nH (分为酸性组,中性组,碱性组 ) (③)控制H选择滴定时,lgay→pH值 5
Analytical Chemistry 5 不同的金属离子,其KMY不同,因而所允许的最低pH 不同。 KMY越大, pHL越小。 酸效应曲线的应用意义 (1)查滴定M时的pH低限; (2)利用lgαY(H)与lgKMY的关系定性考察M与N分别滴定时pH (分为酸性组,中性组,碱性组) (3)控制H+选择滴定时,lgαY(H)→pH值