
3.铬(V四)化合物 ()重铬酸盐的制备: 碱熔氧化 1100C Fe(Cr02)2+8Na2C03+7O2==8Na2Cr04+2Fe203+8C02 酸化并用KC复分解反应: Na2CrO4+H2SO4==NazCr207+Na2S04+H2O Na2Cr207+2KCI==K2Cr207+2NaCl
(1) 重铬酸盐的制备: 碱熔氧化 1100 ºC Fe(CrO2 )2 + 8Na2CO3 + 7O2 === 8Na2CrO4 + 2Fe2O3 + 8CO2 酸化并用KCl复分解反应: Na2CrO4+ H2SO4 == Na2Cr2O7 + Na2SO4 + H2O Na2Cr2O7 + 2KCl == K2Cr2O7 + 2NaCl 3. 铬(Ⅵ)化合物

(2)水溶液中存在以下平衡: 2Cr042-+2H+→ Cr2072-+H20 黄色 橙色 K=4.2X1014 H]7平衡→,pH=4.0,[Cr20,2]占90%,溶液橙色; H+y平衡←-,pH=9.0,[C042]>99%,溶液黄色
(2) 水溶液中存在以下平衡: 2 CrO4 2- + 2 H+ Cr2O7 2- ⎯⎯ ⎯⎯ → + H2O K = 4.2×1014 [H+ ]↗ 平衡 → , pH = 4.0, [Cr2O7 2- ]占90%,溶液橙色; [H+]↘ 平衡 ← , pH = 9.0, [CrO4 2- ] > 99%,溶液黄色。 黄色 橙色
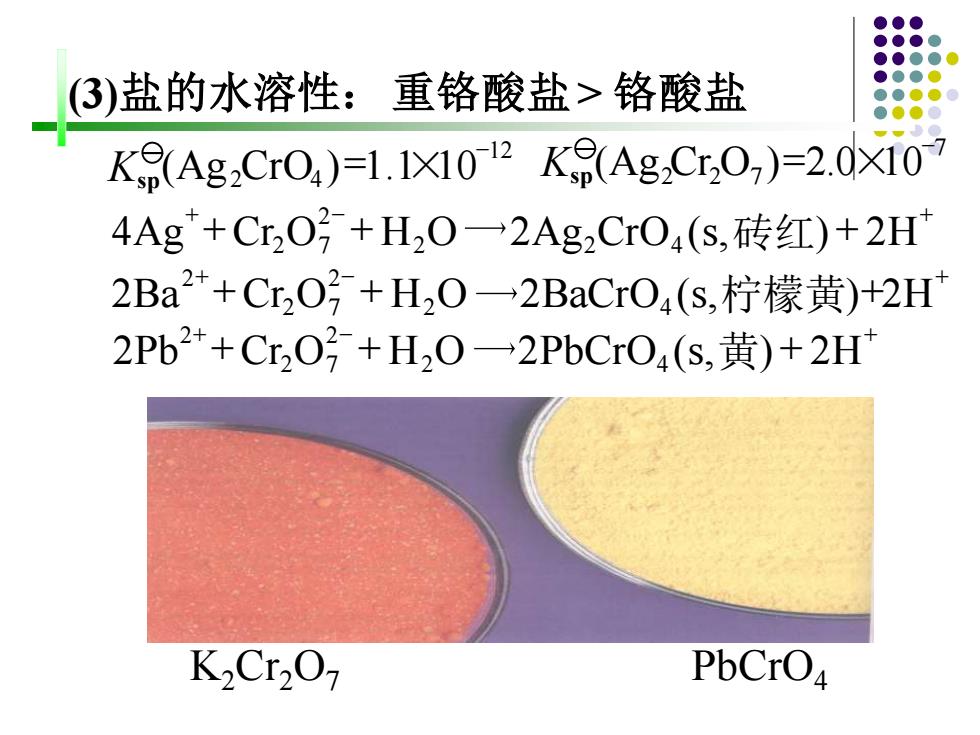
(3)盐的水溶性:重铬酸盐>铬酸盐 K9(AgCr04)=1.1X1012K(Ag,C,0)=2.0X10 4Ag+CrO号+H2O→2Ag2CrO4(s,砖红)+2H 2Ba2+Cr,O号+H,0一→2 BaCrO4(s,柠檬黄)+2H 2Pb2++Cr,02+H20一2 PbCrO4(s,黄)+2H K2Cr2O PbCrO4
- (Ag Cr O )=2.0×10 7 Ksp 2 2 7 - (Ag CrO )=1.1×10 12 Ksp 2 4 + - + 4Ag +Cr O + H2O 2Ag2CrO4 (s, ) + 2H 2 2 7 砖红 + - + 2Ba +Cr O + H2O 2BaCrO4 (s, )+2H 2 2 7 2 柠檬黄 + - + 2Pb +Cr O + H2O 2PbCrO4 (s, ) + 2H 2 2 7 2 黄 K2Cr2O7 PbCrO4 (3)盐的水溶性:重铬酸盐> 铬酸盐

(4)重铬酸盐的强氧化性 0(Cr20,2-/Cr3+)=1.33V o(Cl2/C)=1.36V Cr2072-+14Ht+6e=2Cr3++7H20 mCr20,2-/C3+)=p(Cr20,2-/Cr3+) +(0.059/6)g{[Cr20,2][Ht]14/ICr3+]2} Cl2 +2e=2CI gC2/C)=p(Cl21C)+(0.059/2)g{p(Cl2)/IC} 据Nernst方程,HCI个,g(CrzO,2/Cr3+)个,而gC2/C)N K2Cr20,+14HC1(浓)=2CrCl3+3Cl2↑+2KC1+7H20 Cr20,2+H++Fe2+→Cr3++Fe3+(鉴定Fe2+) Cr20,2-+H++1→Cr3++2+H20 Cr20,2+H+H2C204(草酸)→C3++C02↑
(4) 重铬酸盐的强氧化性 K2Cr2O7 +14 HCl(浓) = 2 CrCl3 + 3 Cl2↑+ 2 KCl + 7 H2O Cr2O7 2- + H+ + Fe2+ → Cr3+ + Fe3+ (鉴定Fe2+) Cr2O7 2- + H+ + I- → Cr3+ + I2 + H2O Cr2O7 2- + H+ + H2C2O4(草酸) → Cr3+ + CO2↑ Cr2O7 2- + 14 H+ + 6 e = 2 Cr3+ + 7 H2O (Cr2O7 2- /Cr3+) = (Cr2O7 2- /Cr3+) + (0.059/6)lg [Cr2O7 2- ] [H+ ] 14 /[Cr3+] 2} Cl2 + 2e = 2Cl- (Cl2 /Cl- ) = (Cl2 /Cl- ) + (0.059/2)lg p(Cl2 ) /[Cl- ]} 据Nernst方程,[HCl],(Cr2O7 2- /Cr3+) , 而(Cl2 /Cl- )↓ (Cr2O7 2- /Cr3+) = 1.33 V (Cl2 /Cl- ) = 1.36 V

●● (⑤)Cr(VD的检验 O/( Cr20,2-+4H,02+2H+ 乙醚或戊醇 2Cr0s+5H20 蓝色 在酸介质中CrO分解: 4Cr0(02)2+6H2S04=2Cr2(S0)3+702↑+2H20 CrOs(过氧化铬)结构 实际是过氧离子O,2以π电子对与Cr()形成配位键。 (C2H)20可占据Cr第4个配位位置,成四面体
4 CrO(O2 ) 2 + 6 H2 SO4 = 2Cr2 (SO)3+ 7 O2 ↑+ 2 H2O 2 CrO5 + 5 H2O 乙醚或戊醇 蓝色 在酸介质中CrO5分解: CrO5 (过氧化铬)结构 O O || O | Cr | O O Cr2O7 2-+ 4 H2O2+ 2 H+ 实际是过氧离子O2 2-以π电子对与Cr(Ⅵ)形成配位键。 (C2H5 ) 2 O可占据Cr第4个配位位置,成四面体。 (5) Cr(VI)的检验