
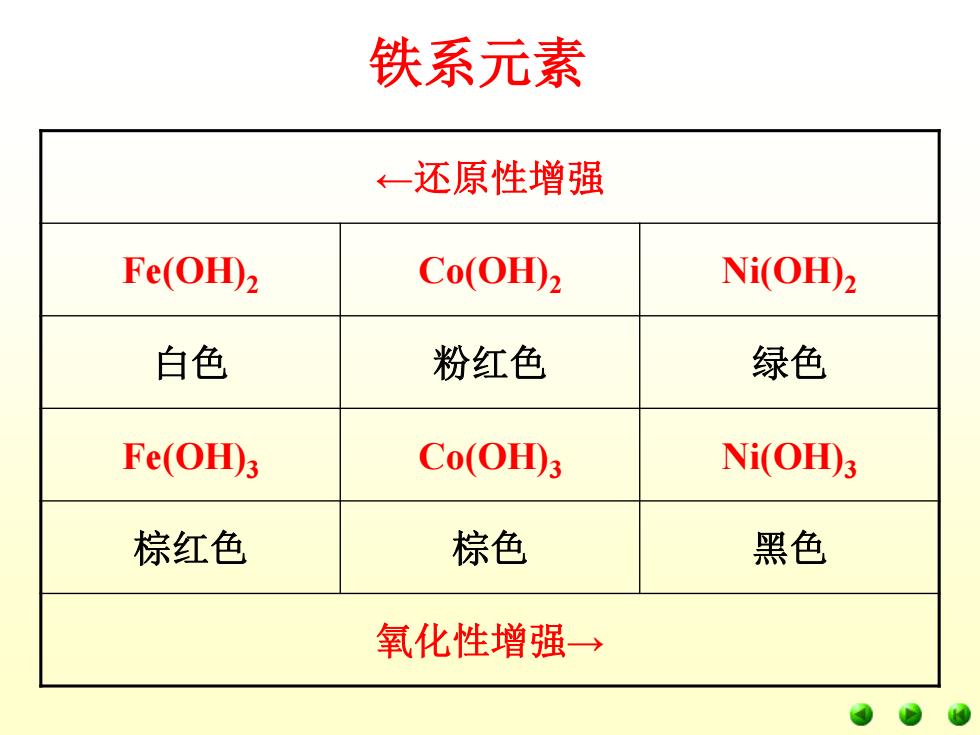
铁系元素 三、重要化合物 1、氢氧化物 M2+2OH===M(OHD2↓ Fe(OH)2在空气中易被氧化为Fe(OH)3 Co(OHD2在空气中可被氧化为Co(OHD)3但较慢。 Ni(OD2在空气中不被氧化为Ni(OHD)3。 Co(OHD2,Ni(OHD2在碱性条件下可被NaCIO、溴 水等氧化为相应的三价氢氧化物。试写出反应方程式。 新沉淀的Fe(OHD3略有两性,能溶于热的浓KOH 溶液,生成KFeO2或K3IFe(OD6。试写出反应方程式。 钴和镍的MO3或M(OHD3都是强氧化剂,当与盐 酸反应时生成MCL,与氯气
铁系元素 三、重要化合物 1、氢氧化物 M2++2OH-===M(OH)2↓ Fe(OH)2在空气中易被氧化为Fe(OH)3 Co(OH)2在空气中可被氧化为Co(OH)3但较慢。 Ni(OH)2在空气中不被氧化为Ni(OH)3。 Co(OH)2、Ni(OH)2在碱性条件下可被NaClO、溴 水等氧化为相应的三价氢氧化物。试写出反应方程式。 新沉淀的Fe(OH)3略有两性,能溶于热的浓KOH 溶液,生成KFeO2或K3 [Fe(OH)6 ]。试写出反应方程式。 钴和镍的M2O3或M(OH)3都是强氧化剂,当与盐 酸反应时生成MCl2与氯气
铁系元素 ←-还原性增强 Fe(OH)2 Co(OH)2 Ni(OH)2 白色 粉红色 绿色 Fe(OH田3 Co(OH)3 Ni(OH)3 棕红色 棕色 黑色 氧化性增强→
铁系元素 ←还原性增强 Fe(OH)2 Co(OH)2 Ni(OH)2 白色 粉红色 绿色 Fe(OH)3 Co(OH)3 Ni(OH)3 棕红色 棕色 黑色 氧化性增强→

铁系元素 2、二价盐 Fe(H20)2+浅绿色,Co(HO)62+粉红色, Ni(H2O)62+亮绿色。 无水Fe(D盐白色,CoD蓝色,NiD黄色。 (NH)2SO4FeSO6H2O- 一摩尔盐。 FeSO47H,O称为绿矾。它与摩尔盐都是常用的 还原剂,但由于摩尔盐较稳定,在分析化学中用得多。 CoC1,常用于干燥剂硅胶中的变色剂。 Ca0r6H,025sc0r2H,0363S0 363K 393K ClH2O=CoCl 粉红 紫红 蓝色 蓝色 当干燥硅胶吸水后,逐渐由蓝色变为粉红色, 表示干燥剂失效,放在烘箱中受热失水后可再用
铁系元素 2、二价盐 Fe(H2O)6 2+浅绿色,Co(H2O)6 2+粉红色, Ni(H2O)6 2+亮绿色。 无水Fe(II)盐白色,Co(II)蓝色,Ni(II)黄色。 (NH4 )2SO4·FeSO4·6H2O——摩尔盐。 FeSO4·7H2O称为绿矾。它与摩尔盐都是常用的 还原剂,但由于摩尔盐较稳定,在分析化学中用得多。 CoCl2常用于干燥剂硅胶中的变色剂。 CoCl 2 . 6H2O CoCl 2 . 2H2O CoCl 2 . H2O CoCl 2 325K 363K 393K 粉 红 紫 红 蓝 色 蓝 色 当干燥硅胶吸水后,逐渐由蓝色变为粉红色, 表示干燥剂失效,放在烘箱中受热失水后可再用

铁系元素 3、三价盐 三价铁盐易水解,具有弱氧化性,可把Sn+、上、 HS、Cu等氧化。 三价钴盐和三价镍盐却不稳定具有强氧化性, 易分解。 Fe3+、A3+和Cr3+有许多相似性,如何分离? 利用AI(OH3和Cr(OHD3主要显两性,Fe(OH)3 主要显碱性。而三价铬盐可被氧化为六价铬盐。 即:先加过量的稀NaOH溶液过滤出Fe(OD)3? 在滤液中加入Na202,把NaCr02氧化为Na2Cr04, 再加适量的酸过滤出A(OH)3°
铁系元素 3、三价盐 三价铁盐易水解,具有弱氧化性,可把Sn2+ 、I -、 H2S、Cu等氧化。 三价钴盐和三价镍盐却不稳定具有强氧化性, 易分解。 Fe3+ 、Al3+和Cr3+有许多相似性,如何分离? 利用Al(OH)3和Cr(OH)3主要显两性,Fe(OH)3 主要显碱性。而三价铬盐可被氧化为六价铬盐。 即:先加过量的稀NaOH溶液过滤出Fe(OH)3, 在滤液中加入Na2O2,把NaCrO2氧化为Na2CrO4, 再加适量的酸过滤出Al(OH)3

铁系元素 四、配合物 1、氨配合物 Fe2+、Fe3+离子不形成氨配合物。 Co2+6NH3→Co(NH3)62+(不稳定易被氧化) [Co(NH3)]3++e===[Co(NH3)6l2+B=0.1V 4[CoNH3)62+02+H20-=4[CoNH3)63+4OH 磁矩测定[CoNH,)62+有3个未成对电子,杂化类 型为sp3d2,[CoNH36+中无未成对电子,杂化类型 为d2sp3,稳定性增强。 [NNH3)6J2+是稳定的配合物,有2个未成对电子, 杂化类型为sp3d2
铁系元素 四、配合物 1、氨配合物 Fe2+ 、Fe3+离子不形成氨配合物。 Co2++6NH3→[Co(NH3 )6 ] 2+(不稳定易被氧化) [Co(NH3 )6 ] 3++e-===[Co(NH3 )6 ] 2+ B=0.1V 4[Co(NH3 )6 ] 2++O2+H2O===4[Co(NH3 )6 ] 3++4OH- 磁矩测定[Co(NH3 )6 ] 2+有3个未成对电子,杂化类 型为sp3d 2 ,[Co(NH3 )6 ] 3+中无未成对电子,杂化类型 为d 2 sp3,稳定性增强。 [Ni(NH3 )6 ] 2+是稳定的配合物,有2个未成对电子, 杂化类型为sp3d 2