碳硅硼 碳 硅 作 碳族元素通性 错分族 碳硅硼化物 无机化合物的水解性 本章要求
碳 硅 硼 碳族元素通性 碳 锗分族 无机化合物的水解性 作业 本章要求 硅 碳硅硼化物

碳族元素 碳、硅属于同一族,有 表中处于对角线位置,也有 放在一起讨论。 碳(Carbon) 是有机世! 链的能力最强,因此碳的化 硅(Silicon) 贝采利乌其 (石头)中译为“矽”,因 硅是无机世界的主角,二氧 分。 贝采利乌斯,JJ
碳、硅属于同一族,有相似性。而硼和硅在周期 表中处于对角线位置,也有相似性,所以本章将它们 放在一起讨论。 碳(Carbon) 是有机世界的主角,由于碳自相成 链的能力最强,因此碳的化合物是最多的。 硅(Silicon) 贝采利乌斯1823年发现,拉丁文 (石头)中译为“矽”,因与锡同音,改为“硅”。 硅是无机世界的主角,二氧化硅是构成地壳的主要成 分。 碳族元素的通性
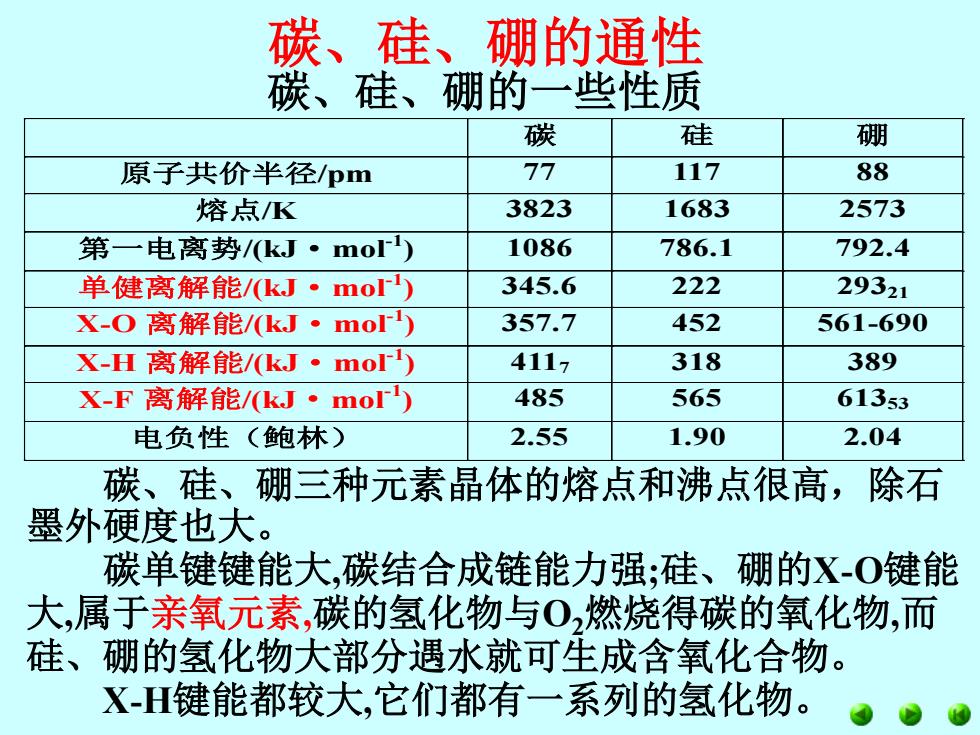
碳、硅、硼的通性 碳、硅、硼的一些性质 碳 硅 硼 原子共价半径pm 77 117 88 熔点K 3823 1683 2573 第一电离势/(kJ·mor) 1086 786.1 792.4 单健离解能/kJ·mo) 345.6 222 29321 X-O离解能/(kJ·mo) 357.7 452 561-690 x-H离解能/kJ·mo) 4117 318 389 x-F离解能/kJ·mo 485 565 61353 电负性(鲍林) 2.55 1.90 2.04 碳、硅、硼三种元素晶体的熔点和沸点很高,除石 墨外硬度也大。 碳单键键能大,碳结合成链能力强;硅、硼的X-O键能 大,属于亲氧元素,碳的氢化物与0,燃烧得碳的氧化物,而 硅、硼的氢化物大部分遇水就可生成含氧化合物。 XH键能都较大,它们都有一系列的氢化物
碳、硅、硼的通性 碳 硅 硼 原子共价半径/pm 77 117 88 熔点/K 3823 1683 2573 第一电离势/(kJ·mol-1 ) 1086 786.1 792.4 单健离解能/(kJ·mol-1 ) 345.6 222 29321 X-O 离解能/(kJ·mol-1 ) 357.7 452 561-690 X-H 离解能/(kJ·mol-1 ) 4117 318 389 X-F 离解能/(kJ·mol-1 ) 485 565 61353 电负性(鲍林) 2.55 1.90 2.04 碳、硅、硼三种元素晶体的熔点和沸点很高,除石 墨外硬度也大。 碳单键键能大,碳结合成链能力强;硅、硼的X-O键能 大,属于亲氧元素,碳的氢化物与O2燃烧得碳的氧化物,而 硅、硼的氢化物大部分遇水就可生成含氧化合物。 X-H键能都较大,它们都有一系列的氢化物。 碳、硅、硼的一些性质

碳、硅、硼的通性 碳、硅、硼的氧化态 电子构型 常见氧化态 c [He]2s22p2 -2,-4,0,+2,+4 Si [Ne]3s23p2 -4,0,+2.+4 B [He]2s22p Q,+3
碳、硅、硼的通性 电子构型 常见氧化态 C [He]2s22p2 -2,-4,0,+2,+4 Si [Ne]3s23p2 -4,0,+2,+4 B [He]2s22p1 0,+3 碳、硅、硼的氧化态

碳、硅、硼的通性 碳、硅的成键特征: 碳与硅的价电子构型为ns2np2,价电子数目与价 电子轨道数相等,它们被称为等电子原子。 硼的价电子构型为2s22p',价电子数少于价电子 轨道数,所以它是缺电子原子。 碳和硅可以用sp、Sp2和sp杂化轨道形成2到4个 σ键。碳的原子半径小,还能形成p元-pπ键,所以碳 能形成多重键(双键或叁键),硅的半径大,不易形成 pπ-pπ键,所以Si的sp和sp态不稳定,很难形成多 重键双键或叁键)
碳、硅、硼的通性 碳、硅的成键特征: 碳与硅的价电子构型为ns2np2 ,价电子数目与价 电子轨道数相等,它们被称为等电子原子。 硼的价电子构型为2s22p1 ,价电子数少于价电子 轨道数,所以它是缺电子原子。 碳和硅可以用sp、sp2和sp3杂化轨道形成2到4个 s键。碳的原子半径小,还能形成pp-pp键,所以碳 能形成多重键(双键或叁键),硅的半径大,不易形成 pp-pp键,所以Si的sp和sp2态不稳定,很难形成多 重键(双键或叁键)