
第七章:化学反应速度 化学反应速度 浓度的影响 反应机理 温度的影 催化剂的影响 本章要求
第七章:化学反应速度 化 学 反 应 速 度 浓 度 的 影 响 作 业 本 章 要 求 反 应 机 理 催 化 剂 的 影 响 温 度 的 影 响

化学反应速度 一、化学反应速度表示法 化学反应速度是用单位时间内反应物浓度的减少 或生成物浓度的增加来表示的:单位用moL1sl、 mol-L-1.min-1、mol-L-1.h-l。 如:某给定温度下,在密闭容器中氮气与氢气反应 生成氨,各物质变化浓度如下: N2+3H2 占 2NH; 起始(molL) 1.03.0 0 3秒后浓度(mol/L)0.7 2.1 0.6 计算该反应速度。(反应速度为正值) 解: (0.7-1.0) =0.1(molL.s) 3
化学反应速度 一、化学反应速度表示法 化学反应速度是用单位时间内反应物浓度的减少 或生成物浓度的增加来表示的:单位用mol·L-1·s-1 、 mol·L-1·min-1 、mol·L-1·h-1 。 如:某给定温度下,在密闭容器中氮气与氢气反应 生成氨,各物质变化浓度如下: N2 + 3H2 2NH3 起始 (mol/L) 1.0 3.0 0 3秒后浓度(mol/L) 0.7 2.1 0.6 计算该反应速度。(反应速度为正值) 解: 0.1(mol L s ) 3 (0.7 1.0) -1 -1 2 vN

化学反应速度 (2.1-3.0) VH2 =0.3(molL'.s) 06-0=02's) 3 且存在着:,=方:=2V, 3 随反应的不断进行,由于反应物的浓度不断减少, 生成物的浓度不断增加,因此,大部分化学反应都不是 等速进行的,因此上述所计算的反应速度是该段时间内 的平均反应速度
化学反应速度 且存在着: 0.3(mol L s ) 3 (2.1 3.0) -1 -1 2 vH 0.2(mol L s ) 3 (0.6 0) -1 -1 3 vN H 2 2 3 2 1 3 1 N H N H v v v 随反应的不断进行,由于反应物的浓度不断减少, 生成物的浓度不断增加,因此,大部分化学反应都不是 等速进行的,因此上述所计算的反应速度是该段时间内 的平均反应速度

化学反应速度 只有在某一瞬间的反应速度才代表化学反应在某 一时刻的真正速度。我们通常说瞬时速度。 即上述反应的瞬时速度可表示为 -dN2] -dH2] d[NH;] VN, dt dt dt 三个速度不同且有:N]=1,-a,]_1.dNH,] dt 3 dt 2 dt 对于反应 aA+bB台dD+eE 1。-d[A]_1。-dB]_1d[D]1dE] ● a dt b dt d dt e dt
化学反应速度 只有在某一瞬间的反应速度才代表化学反应在某 一时刻的真正速度。我们通常说瞬时速度。 即上述反应的瞬时速度可表示为 三个速度不同且有: dt d vN [N ] 2 2 dt d vH [H ] 2 2 dt d vNH [NH ] 3 3 dt d dt d dt d [NH ] 2 [H ] 1 3 [N2 ] 1 2 3 对于反应 aA + bB dD+eE dt d dt e d dt d d dt b d a 1 [A] 1 [B] 1 [D] 1 [E]
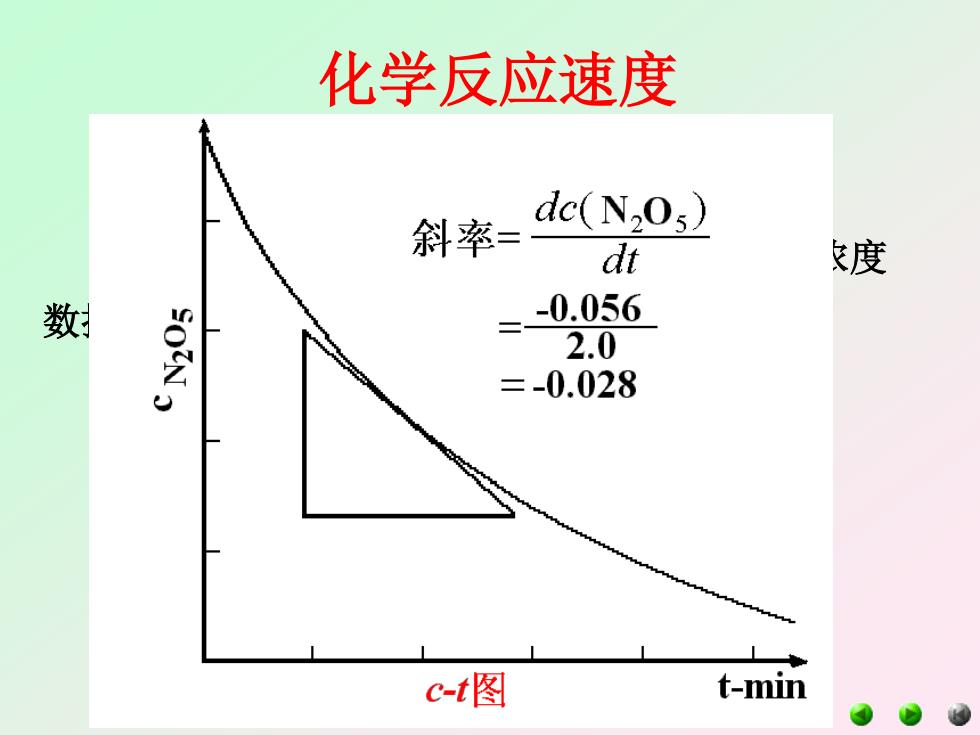
化学反应速度 斜率= dc(N2O3) dt 度 数 -0.056 SOIN 2.0 =-0.028 c-t图 t-min
化学反应速度 二、化学反应速度的实验测定 某种物质在化学反应过程中不同时间下的浓度 数据做c-t曲线 如: 2N2O54NO2 +O2 由实验数据画图然后做任意一点的切线。 这样即可求得任意浓度时的瞬时反应速度。 再根据c-v做图,即可得到速率方程