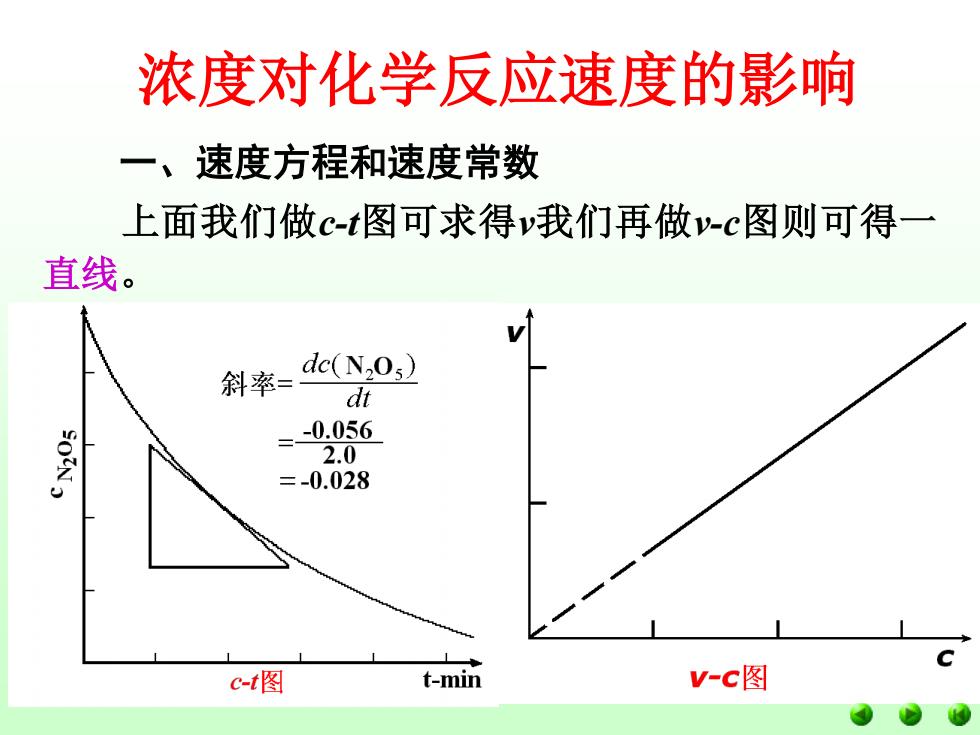
浓度对化学反应速度的影响 一、速度方程和速度常数 上面我们做c-t图可求得我们再做-c图则可得一 直线。 斜率= de(N2O3) dt =-0.056 2.0 =-0.028 c-t图 t-min V-c图
浓度对化学反应速度的影响 一、速度方程和速度常数 上面我们做c-t图可求得v我们再做v-c图则可得一 直线。 即v∝[N2O5 ]或v=k[N2O5 ] 此式称为N2O5的反应速率方程,k为比例系数。 即[N2O5 ]=1mol/L时,v=k。 所以k的物理意义为单位浓度时的反应速度。 k大则v大,k小则v小,k与浓度无关温度升高则k增 大

浓度对化学反应速度的影响 例:340K时[N20]=0.160mo/L,=0.056mo-L1min-1 计算该反应的速度常数及N,0,浓度为0.100mol/L时 的=? 解:①由=kN2Os ∴.k=v/[N20s=0.056/0.160=0.35(min-) ②w=kN20s=0.35×0.100=0.035(moL-1min-) 答:y=0.035moL1min1
浓度对化学反应速度的影响 例:340K时[N2O5 ]=0.160mol/L,v=0.056mol·L-1·min-1 计算该反应的速度常数及N2O5浓度为0.100mol/L时 的v=? 解:①由v=k[N2O5 ] ∴k=v/[N2O5 ]=0.056/0.160=0.35(min-1 ) ②v=k[N2O5 ]=0.35×0.100=0.035(mol·L-1·min-1 ) 答:v=0.035mol·L-1·min-1

浓度对化学反应速度的影响 不同的化学反应有不同的速度方程和速度常数。 只有通过实验才能得到,现在还没有一种理论来推导反 应速度和速度常数。 对于反应 aA+bB===dD+eE 其速度方程一般情况下可表示为:v=kAmB” m、n分别表示A和B的浓度的指数,分别称为反应物A 和B的反应级数。什n该反应的总反应级数
浓度对化学反应速度的影响 不同的化学反应有不同的速度方程和速度常数。 只有通过实验才能得到,现在还没有一种理论来推导反 应速度和速度常数。 对于反应 aA + bB === dD+eE 其速度方程一般情况下可表示为:v=k[A]m·[B]n m、n分别表示A和B的浓度的指数,分别称为反应物A 和B的反应级数。m+n该反应的总反应级数

浓度对化学反应速度的影响 如:2H202=2H20+02 =[H2O21 =1为一级反应 S20g2-+2=2S042-+L2=k[S20g2] =1,n=1,S,0g2、上分别为一级反应 什n=2即整个反应为二级反应。 4HBr+O2===2H2O+2Br2 v=k[HBr][O2] F1,n=1,tn=2
浓度对化学反应速度的影响 如:2H2O2 ===2H2O + O2 v=k[H2O2 ] m=1为一级反应 S2O8 2-+2I - ===2SO4 2-+I2 v=k[S2O8 2- ][I- ] m=1,n=1,S2O8 2-、I -分别为一级反应 m+n=2即整个反应为二级反应。 4HBr+O2 ===2H2O+2Br2 v=k[HBr][O2 ] m=1,n=1,m+n=2

浓度对化学反应速度的影响 2N0+2H2==N2+2H20=kNO]2H2 NO为二级反应,H为一级反应,总反应为三级反应。 CH,CHO--=CH+CO =CHCHO]32 即为32级反应 反应级数不一定是整数,可以是分数,也可以为零。 级数为零的反应叫零级反应。即浓度变化,速度不变。 确定速度方程,必须以实验事实为依据
浓度对化学反应速度的影响 2NO+2H2 ===N2 +2H2O v=k[NO]2 [H2 ] NO为二级反应,H2为一级反应,总反应为三级反应。 CH3CHO===CH4 +CO v=k[CH3CHO]3/2 即为3/2级反应 反应级数不一定是整数,可以是分数,也可以为零。 级数为零的反应叫零级反应。即浓度变化,速度不变。 确定速度方程,必须以实验事实为依据