
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 11 2. 三氧化铬 Na2Cr2O7 或 K2Cr2O7 的固体或浓溶液中加入浓硫酸可析出暗红色 CrO3 针状晶 体,工业上制取 CrO3 以 Na2Cr2O7 为起始物: Na2Cr2O7·2H2O(s) + 2H2SO4(浓) 2CrO3(s) + 2NaHSO4(aq) + 3H2O(l) CrO3 表现出强氧化性、热不稳定性和水溶性。有机物遇 CrO3 发生猛烈反应以至着火,加热超 过熔点(197℃)则逐步分解,经过一系列中间氧化态, 最后生成 Cr2O3。 3. 氯化铬酰 人们将氯化硫酰 SO2Cl2 看作 H2SO4 分子中的两个 OH 被 Cl 取代的产物,同样 可将氯化铬酰 CrO2C12可看作 H2CrO4分子中的两个 OH 被 C1 所取代。CrO2Cl2为四面体形共价分子, 通常状况下为深红色液体(b.p. 117℃),外观似溴,能与 CCl4,CS2,CHCl3 等有机溶剂互溶。于 K2Cr2O7 与 KCl 的固体混合物中滴人浓 H2SO4 可以制得 CrO2Cl2: K2Cr2O7(s) 4KCl(s) + 3H2SO4(浓) 2CrO2Cl2(l) + 3K2SO4(aq) + 3H2O(1) 将反应容器在砂浴上缓缓加热,CrO2C12 即可被蒸馏出来。钢铁分析中有时需要消除铬的干扰,溶 解试样时加人 NaCl 并加入 HClO4 蒸发至冒烟,使其以 CrO2Cl2 形式挥发: Cr2O7 2-(aq) + 4Cl- (aq) + 6H3O+ (aq) 2CrO2Cl2(g) + 9H2O(l) 4. 三氧化二铬和碱式硫酸铬 Cr2O3 用于制造颜料和耐高温陶瓷, 可由焦炭还原 Na2Cr2O7 的 方法制备: Δ 2 Na2Cr2O7(s)+ 3 C(s) 2 Cr2O3(s) + 2 Na2CO3(s) + CO2(g) 用水沥取反应产物中的可溶性杂质,然后经过滤、干燥、研磨即得纯度很高(含 Cr2O399%)的颜 料级产品。 Cr2O3 是两性化合物,溶于酸得 Cr(Ⅲ)盐,溶于强碱生成亚铬酸盐: Cr2O3(s) + 3 H2SO4(aq) Cr2(SO4)3(aq) + 3 H2O(l) Cr2O3(s) + 2 NaOH(aq) +3 H2O(l) 2 NaCr(OH)4(aq) 加碱于 Cr(Ⅲ)盐溶液析出灰蓝色水合三氧化二铬胶状沉淀 Cr2O3·nH2O。水合三氧化二铬也显 两性,与酸、碱发生类似于 Cr2O3 的反应。 铬化合物使兽皮中的胶原羧基发生交联的过程叫铬鞣。碱式硫酸铬是重要的铬鞣剂。从世界范 围讲,铬鞣消耗的铬化合物约占铬化合物总产量的 1/3!工业上制备 Cr(OH)SO4 可以采用不同途径, 例如用 SO2 还原重铬酸钠: Na2Cr2O7(aq) + 3 SO2(g) + H2O(l) Na2SO4(aq) + 2Cr(OH)SO4(s) 反应中生成的 Na2SO4 是铬鞣过程中的缓冲剂,因而不必与 Cr(OH)SO4 分离。 5. Cr(Ⅲ)的氧化还原性和配位化合物 Cr(Ⅲ)是铬的最稳定氧化态,Cr2O7 2-在酸性溶液中的还 原产物总是 Cr3+离子。酸性溶液中的 Cr3+离子不是还原剂,同样也不是典型的氧化剂,只有强还原 剂才能将其还原为 Cr2+离子: 2 Cr3+(aq) + Zn(s) 2 Cr2+(aq) + Zn2+(aq) 碱性溶液中的 Cr(Ⅲ)物种 Cr(OH)3 和 Cr(OH)4 - 具有还原性。例如可被 H2O2 氧化为 CrO4 2-: 2 Cr(OH)4 - (aq) + 3 H2O2(aq) + 2 OH- (aq) 2CrO4 2-(aq) + 8 H2O(l) Cr(Ⅲ)形成配合物的能力特强,凡能提供电子对的物种如 H2O,CN- ,NH3,C2O4 2-等都可作为 配位体。由于 Cr(III)配合物中的配位体交换过程进行得十分缓慢,往往会出现多种稳定的水合异构 体。例如 CrCl3·6H2O 存在三种水合异构体:
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 11 2. 三氧化铬 Na2Cr2O7 或 K2Cr2O7 的固体或浓溶液中加入浓硫酸可析出暗红色 CrO3 针状晶 体,工业上制取 CrO3 以 Na2Cr2O7 为起始物: Na2Cr2O7·2H2O(s) + 2H2SO4(浓) 2CrO3(s) + 2NaHSO4(aq) + 3H2O(l) CrO3 表现出强氧化性、热不稳定性和水溶性。有机物遇 CrO3 发生猛烈反应以至着火,加热超 过熔点(197℃)则逐步分解,经过一系列中间氧化态, 最后生成 Cr2O3。 3. 氯化铬酰 人们将氯化硫酰 SO2Cl2 看作 H2SO4 分子中的两个 OH 被 Cl 取代的产物,同样 可将氯化铬酰 CrO2C12可看作 H2CrO4分子中的两个 OH 被 C1 所取代。CrO2Cl2为四面体形共价分子, 通常状况下为深红色液体(b.p. 117℃),外观似溴,能与 CCl4,CS2,CHCl3 等有机溶剂互溶。于 K2Cr2O7 与 KCl 的固体混合物中滴人浓 H2SO4 可以制得 CrO2Cl2: K2Cr2O7(s) 4KCl(s) + 3H2SO4(浓) 2CrO2Cl2(l) + 3K2SO4(aq) + 3H2O(1) 将反应容器在砂浴上缓缓加热,CrO2C12 即可被蒸馏出来。钢铁分析中有时需要消除铬的干扰,溶 解试样时加人 NaCl 并加入 HClO4 蒸发至冒烟,使其以 CrO2Cl2 形式挥发: Cr2O7 2-(aq) + 4Cl- (aq) + 6H3O+ (aq) 2CrO2Cl2(g) + 9H2O(l) 4. 三氧化二铬和碱式硫酸铬 Cr2O3 用于制造颜料和耐高温陶瓷, 可由焦炭还原 Na2Cr2O7 的 方法制备: Δ 2 Na2Cr2O7(s)+ 3 C(s) 2 Cr2O3(s) + 2 Na2CO3(s) + CO2(g) 用水沥取反应产物中的可溶性杂质,然后经过滤、干燥、研磨即得纯度很高(含 Cr2O399%)的颜 料级产品。 Cr2O3 是两性化合物,溶于酸得 Cr(Ⅲ)盐,溶于强碱生成亚铬酸盐: Cr2O3(s) + 3 H2SO4(aq) Cr2(SO4)3(aq) + 3 H2O(l) Cr2O3(s) + 2 NaOH(aq) +3 H2O(l) 2 NaCr(OH)4(aq) 加碱于 Cr(Ⅲ)盐溶液析出灰蓝色水合三氧化二铬胶状沉淀 Cr2O3·nH2O。水合三氧化二铬也显 两性,与酸、碱发生类似于 Cr2O3 的反应。 铬化合物使兽皮中的胶原羧基发生交联的过程叫铬鞣。碱式硫酸铬是重要的铬鞣剂。从世界范 围讲,铬鞣消耗的铬化合物约占铬化合物总产量的 1/3!工业上制备 Cr(OH)SO4 可以采用不同途径, 例如用 SO2 还原重铬酸钠: Na2Cr2O7(aq) + 3 SO2(g) + H2O(l) Na2SO4(aq) + 2Cr(OH)SO4(s) 反应中生成的 Na2SO4 是铬鞣过程中的缓冲剂,因而不必与 Cr(OH)SO4 分离。 5. Cr(Ⅲ)的氧化还原性和配位化合物 Cr(Ⅲ)是铬的最稳定氧化态,Cr2O7 2-在酸性溶液中的还 原产物总是 Cr3+离子。酸性溶液中的 Cr3+离子不是还原剂,同样也不是典型的氧化剂,只有强还原 剂才能将其还原为 Cr2+离子: 2 Cr3+(aq) + Zn(s) 2 Cr2+(aq) + Zn2+(aq) 碱性溶液中的 Cr(Ⅲ)物种 Cr(OH)3 和 Cr(OH)4 - 具有还原性。例如可被 H2O2 氧化为 CrO4 2-: 2 Cr(OH)4 - (aq) + 3 H2O2(aq) + 2 OH- (aq) 2CrO4 2-(aq) + 8 H2O(l) Cr(Ⅲ)形成配合物的能力特强,凡能提供电子对的物种如 H2O,CN- ,NH3,C2O4 2-等都可作为 配位体。由于 Cr(III)配合物中的配位体交换过程进行得十分缓慢,往往会出现多种稳定的水合异构 体。例如 CrCl3·6H2O 存在三种水合异构体:
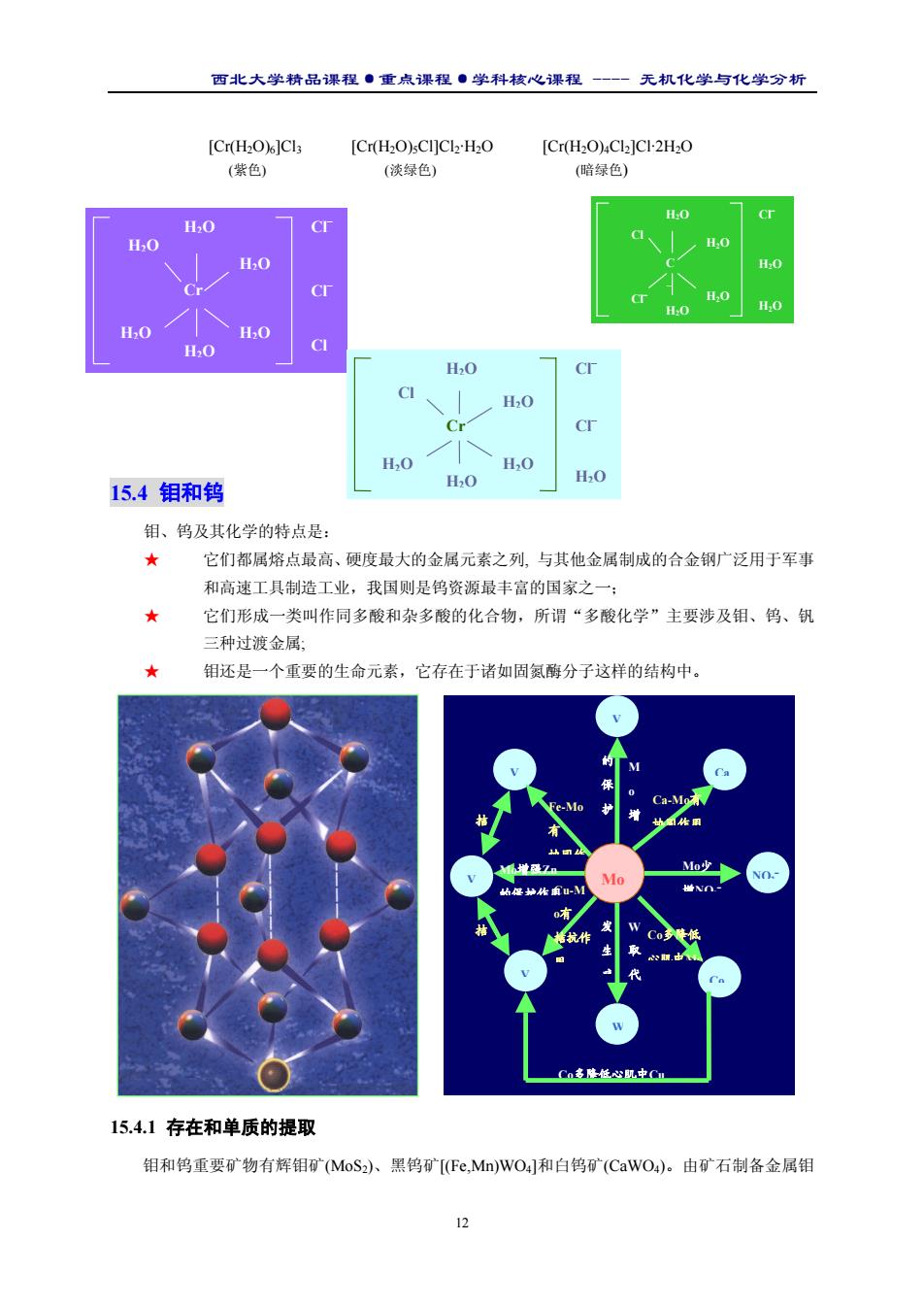
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 12 [Cr(H2O)6]Cl3 [Cr(H2O)5Cl]Cl2·H2O [Cr(H2O)4Cl2]Cl·2H2O (紫色) (淡绿色) (暗绿色) 15.4 钼和钨 钼、钨及其化学的特点是: ★ 它们都属熔点最高、硬度最大的金属元素之列, 与其他金属制成的合金钢广泛用于军事 和高速工具制造工业,我国则是钨资源最丰富的国家之一; ★ 它们形成一类叫作同多酸和杂多酸的化合物,所谓“多酸化学”主要涉及钼、钨、钒 三种过渡金属; ★ 钼还是一个重要的生命元素,它存在于诸如固氮酶分子这样的结构中。 15.4.1 存在和单质的提取 钼和钨重要矿物有辉钼矿(MoS2)、黑钨矿[(Fe,Mn)WO4]和白钨矿(CaWO4)。由矿石制备金属钼 Cr H2O H2O H2O Cl H2O H2O Cl– H2O Cl– Cr H2O H2O H2O Cl H2O H2O Cl– H2O Cl– C r H2O H2O H2O Cl H2O H2O Cl– H2O Cl– Mo V V Ca V W V Co Mo少 增NO2 – Co多降低心肌中Cu W 取 代 发 生 病 Co多降低 心肌中Mo Ca-Mo有 协同作用 M o 增 的 保 护 Cu-M o有 拮抗作 用 Fe-Mo 有 协同作 Mo增强Zn 的保护作用 拮 拮 NO2 –
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 12 [Cr(H2O)6]Cl3 [Cr(H2O)5Cl]Cl2·H2O [Cr(H2O)4Cl2]Cl·2H2O (紫色) (淡绿色) (暗绿色) 15.4 钼和钨 钼、钨及其化学的特点是: ★ 它们都属熔点最高、硬度最大的金属元素之列, 与其他金属制成的合金钢广泛用于军事 和高速工具制造工业,我国则是钨资源最丰富的国家之一; ★ 它们形成一类叫作同多酸和杂多酸的化合物,所谓“多酸化学”主要涉及钼、钨、钒 三种过渡金属; ★ 钼还是一个重要的生命元素,它存在于诸如固氮酶分子这样的结构中。 15.4.1 存在和单质的提取 钼和钨重要矿物有辉钼矿(MoS2)、黑钨矿[(Fe,Mn)WO4]和白钨矿(CaWO4)。由矿石制备金属钼 Cr H2O H2O H2O Cl H2O H2O Cl– H2O Cl– Cr H2O H2O H2O Cl H2O H2O Cl– H2O Cl– C r H2O H2O H2O Cl H2O H2O Cl– H2O Cl– Mo V V Ca V W V Co Mo少 增NO2 – Co多降低心肌中Cu W 取 代 发 生 病 Co多降低 心肌中Mo Ca-Mo有 协同作用 M o 增 的 保 护 Cu-M o有 拮抗作 用 Fe-Mo 有 协同作 Mo增强Zn 的保护作用 拮 拮 NO2 –