
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 第十二章 s 区元素 Chapter 12 s Block 教学要求 1.了解 s 区元素的物理性质和化学性质,能够解释 Li 的标准电极电势为什么最低,能解释 碱金属与水、醇和液氨反应的不同; 2.了解主要元素的矿物资源及单质的制备方法,特别注意钾和钠制备方法的不同; 3.了解 s 区元素的氢化物、氧化物、氢氧化物的性质,特别注意氢氧化物的碱性变化规律; 4.了解 s 区元素的重要盐类化合物,特别注意盐类溶解性的热力学解释; 5.会用离子极化理论解释碳酸盐分解规律; 6.了解对角线规则和锂、铍的特殊性。 课时分配(4 学时) 1. 概述和单质:2 学时 2. 化合物:2 学时 3. 对角线规则:1 学时 12.1 概述 alkaline metals alkaline earth matals lithium beryllium sodium magnesium potassium calcium rubidium strontium caesium barium francium radium 注意它们在周期表中的位置。所有性质的产生和变化规律皆由此而来。 s 区属元素最外层电子组态分别为 ns 1和 ns 2 ,由于受到内层电子的强烈屏蔽, 核对最外层电 子的控制较松弛。因而单质的化学性质都非常活泼, 容易失去各自的 ns 电子分别形成+1 价和+2 价阳离子, 其氧化态与各自的族号相对应。 12.2 单质 12.2.1 物理和化学性质
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 第十二章 s 区元素 Chapter 12 s Block 教学要求 1.了解 s 区元素的物理性质和化学性质,能够解释 Li 的标准电极电势为什么最低,能解释 碱金属与水、醇和液氨反应的不同; 2.了解主要元素的矿物资源及单质的制备方法,特别注意钾和钠制备方法的不同; 3.了解 s 区元素的氢化物、氧化物、氢氧化物的性质,特别注意氢氧化物的碱性变化规律; 4.了解 s 区元素的重要盐类化合物,特别注意盐类溶解性的热力学解释; 5.会用离子极化理论解释碳酸盐分解规律; 6.了解对角线规则和锂、铍的特殊性。 课时分配(4 学时) 1. 概述和单质:2 学时 2. 化合物:2 学时 3. 对角线规则:1 学时 12.1 概述 alkaline metals alkaline earth matals lithium beryllium sodium magnesium potassium calcium rubidium strontium caesium barium francium radium 注意它们在周期表中的位置。所有性质的产生和变化规律皆由此而来。 s 区属元素最外层电子组态分别为 ns 1和 ns 2 ,由于受到内层电子的强烈屏蔽, 核对最外层电 子的控制较松弛。因而单质的化学性质都非常活泼, 容易失去各自的 ns 电子分别形成+1 价和+2 价阳离子, 其氧化态与各自的族号相对应。 12.2 单质 12.2.1 物理和化学性质
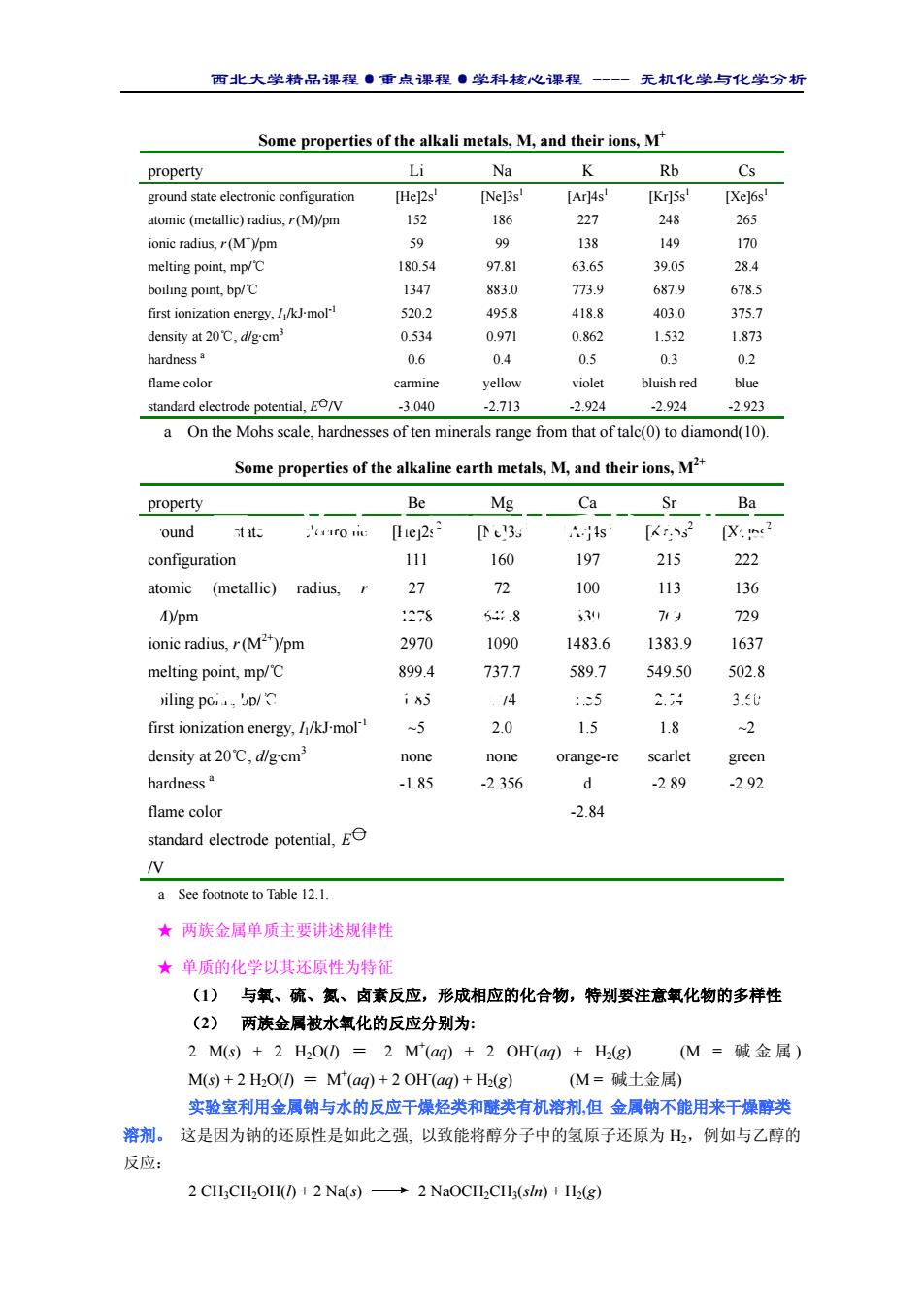
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 Some properties of the alkali metals, M, and their ions, M+ property Li Na K Rb Cs ground state electronic configuration atomic (metallic) radius, r(M)/pm ionic radius, r(M+ )/pm melting point, mp/℃ boiling point, bp/℃ first ionization energy, I1/kJ·mol-1 density at 20℃, d/g·cm3 hardness a flame color standard electrode potential, E○一/V [He]2s1 152 59 180.54 1347 520.2 0.534 0.6 carmine -3.040 [Ne]3s1 186 99 97.81 883.0 495.8 0.971 0.4 yellow -2.713 [Ar]4s1 227 138 63.65 773.9 418.8 0.862 0.5 violet -2.924 [Kr]5s1 248 149 39.05 687.9 403.0 1.532 0.3 bluish red -2.924 [Xe]6s1 265 170 28.4 678.5 375.7 1.873 0.2 blue -2.923 a On the Mohs scale, hardnesses of ten minerals range from that of talc(0) to diamond(10). Some properties of the alkaline earth metals, M, and their ions, M2+ property Be Mg Ca Sr Ba ground state electronic configuration atomic (metallic) radius, r (M)/pm ionic radius, r(M2+)/pm melting point, mp/℃ boiling point, bp/℃ first ionization energy, I1/kJ·mol-1 density at 20℃, d/g·cm3 hardness a flame color standard electrode potential, E○一 /V [He]2s2 111 27 1278 2970 899.4 1.85 ~5 none -1.85 [Ne]3s2 160 72 648.8 1090 737.7 1.74 2.0 none -2.356 [Ar]4s2 197 100 839 1483.6 589.7 1.55 1.5 orange-re d -2.84 [Kr]5s2 215 113 769 1383.9 549.50 2.54 1.8 scarlet -2.89 [Xe]6s2 222 136 729 1637 502.8 3.60 ~2 green -2.92 a See footnote to Table 12.1. ★ 两族金属单质主要讲述规律性 ★ 单质的化学以其还原性为特征 (1) 与氧、硫、氮、卤素反应,形成相应的化合物,特别要注意氧化物的多样性 (2) 两族金属被水氧化的反应分别为: 2 M(s) + 2 H2O(l) = 2 M+ (aq) + 2 OH- (aq) + H2(g) (M = 碱金属 ) M(s) + 2 H2O(l) = M+ (aq) + 2 OH- (aq) + H2(g) (M = 碱土金属) 实验室利用金属钠与水的反应干燥烃类和醚类有机溶剂,但 金属钠不能用来干燥醇类 溶剂。 这是因为钠的还原性是如此之强, 以致能将醇分子中的氢原子还原为 H2,例如与乙醇的 反应: 2 CH3CH2OH(l) + 2 Na(s) 2 NaOCH2CH3(sln) + H2(g) ● 形成的化合物大多是离子型的 ● 通常只有一种稳定的氧化态 ● 同一族自上而下性质的变化有规律
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 Some properties of the alkali metals, M, and their ions, M+ property Li Na K Rb Cs ground state electronic configuration atomic (metallic) radius, r(M)/pm ionic radius, r(M+ )/pm melting point, mp/℃ boiling point, bp/℃ first ionization energy, I1/kJ·mol-1 density at 20℃, d/g·cm3 hardness a flame color standard electrode potential, E○一/V [He]2s1 152 59 180.54 1347 520.2 0.534 0.6 carmine -3.040 [Ne]3s1 186 99 97.81 883.0 495.8 0.971 0.4 yellow -2.713 [Ar]4s1 227 138 63.65 773.9 418.8 0.862 0.5 violet -2.924 [Kr]5s1 248 149 39.05 687.9 403.0 1.532 0.3 bluish red -2.924 [Xe]6s1 265 170 28.4 678.5 375.7 1.873 0.2 blue -2.923 a On the Mohs scale, hardnesses of ten minerals range from that of talc(0) to diamond(10). Some properties of the alkaline earth metals, M, and their ions, M2+ property Be Mg Ca Sr Ba ground state electronic configuration atomic (metallic) radius, r (M)/pm ionic radius, r(M2+)/pm melting point, mp/℃ boiling point, bp/℃ first ionization energy, I1/kJ·mol-1 density at 20℃, d/g·cm3 hardness a flame color standard electrode potential, E○一 /V [He]2s2 111 27 1278 2970 899.4 1.85 ~5 none -1.85 [Ne]3s2 160 72 648.8 1090 737.7 1.74 2.0 none -2.356 [Ar]4s2 197 100 839 1483.6 589.7 1.55 1.5 orange-re d -2.84 [Kr]5s2 215 113 769 1383.9 549.50 2.54 1.8 scarlet -2.89 [Xe]6s2 222 136 729 1637 502.8 3.60 ~2 green -2.92 a See footnote to Table 12.1. ★ 两族金属单质主要讲述规律性 ★ 单质的化学以其还原性为特征 (1) 与氧、硫、氮、卤素反应,形成相应的化合物,特别要注意氧化物的多样性 (2) 两族金属被水氧化的反应分别为: 2 M(s) + 2 H2O(l) = 2 M+ (aq) + 2 OH- (aq) + H2(g) (M = 碱金属 ) M(s) + 2 H2O(l) = M+ (aq) + 2 OH- (aq) + H2(g) (M = 碱土金属) 实验室利用金属钠与水的反应干燥烃类和醚类有机溶剂,但 金属钠不能用来干燥醇类 溶剂。 这是因为钠的还原性是如此之强, 以致能将醇分子中的氢原子还原为 H2,例如与乙醇的 反应: 2 CH3CH2OH(l) + 2 Na(s) 2 NaOCH2CH3(sln) + H2(g) ● 形成的化合物大多是离子型的 ● 通常只有一种稳定的氧化态 ● 同一族自上而下性质的变化有规律

西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 金属钠与卤代溶剂发生的反应十分猛烈, 因而也不能用来干燥这类溶剂。 例如, 与 CCl4 发生的反应为: CCl4(l) + 4 Na(s) 4 NaCl(s) + C(s) △rG○一 m = -249 kJ·mol-1 (3)两族元素的单质都是强还原剂。 以热化学循环讲述。 (4) 属钠与液氨之间发生非常独特的反应。 钠溶于液氨的反应如下: Na(s) + x NH3(l) Na+ (am) + e - (am) 水合电子 Selected reactions of the alkali metals M3 M3N (M = M MNH2 + MOH + 汞 MX (X = 卤 M2O (M = Li, M2C M+ (am) + e - M2 M2O2 (M = Na, K, MO2 (M = K, Rb, P N MH3(溶液或气 H2 M X S 液 有 Fe H O O2 + C
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 金属钠与卤代溶剂发生的反应十分猛烈, 因而也不能用来干燥这类溶剂。 例如, 与 CCl4 发生的反应为: CCl4(l) + 4 Na(s) 4 NaCl(s) + C(s) △rG○一 m = -249 kJ·mol-1 (3)两族元素的单质都是强还原剂。 以热化学循环讲述。 (4) 属钠与液氨之间发生非常独特的反应。 钠溶于液氨的反应如下: Na(s) + x NH3(l) Na+ (am) + e - (am) 水合电子 Selected reactions of the alkali metals M3 M3N (M = M MNH2 + MOH + 汞 MX (X = 卤 M2O (M = Li, M2C M+ (am) + e - M2 M2O2 (M = Na, K, MO2 (M = K, Rb, P N MH3(溶液或气 H2 M X S 液 有 Fe H O O2 + C

西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 Selected reactions of the alkaline earth metals 12.2.2 矿物资源和金属单质制备 由于对水和氧的高度活泼性, s 区金属元素只能以化合物形式存在于自然界。 其中有些元素 在地壳中的丰度相当高,例如钙、钠、镁、钾的丰度分别排在第 5,第 6,第 7 和第 8 位。 ★ 金属锂、金属钠和占总产量 80%的金属镁用熔盐电解法生产。 电解反应如下: 阳极: 2 Cl- Cl2 + 2 e - 阴极: 2 Li+ + 2 e - 2 Li 总反应: 2 LiCl 2 Li + Cl2 ★ 热还原法用来生产金属钾和金属钙。 MO2 (M = Ba), MO MH2 (M = Ca, Sr, Ba) M(NH2)2 + H2 HMO2 - + H2 (M = Be) N H2O 水蒸气 M O2 NH3 MX2 NaOH M3N2 (M = Mg) M(OH)2 + H2 (M = Ca, Sr, Ba) MO + H2 (M = Be, Mg)
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 Selected reactions of the alkaline earth metals 12.2.2 矿物资源和金属单质制备 由于对水和氧的高度活泼性, s 区金属元素只能以化合物形式存在于自然界。 其中有些元素 在地壳中的丰度相当高,例如钙、钠、镁、钾的丰度分别排在第 5,第 6,第 7 和第 8 位。 ★ 金属锂、金属钠和占总产量 80%的金属镁用熔盐电解法生产。 电解反应如下: 阳极: 2 Cl- Cl2 + 2 e - 阴极: 2 Li+ + 2 e - 2 Li 总反应: 2 LiCl 2 Li + Cl2 ★ 热还原法用来生产金属钾和金属钙。 MO2 (M = Ba), MO MH2 (M = Ca, Sr, Ba) M(NH2)2 + H2 HMO2 - + H2 (M = Be) N H2O 水蒸气 M O2 NH3 MX2 NaOH M3N2 (M = Mg) M(OH)2 + H2 (M = Ca, Sr, Ba) MO + H2 (M = Be, Mg)
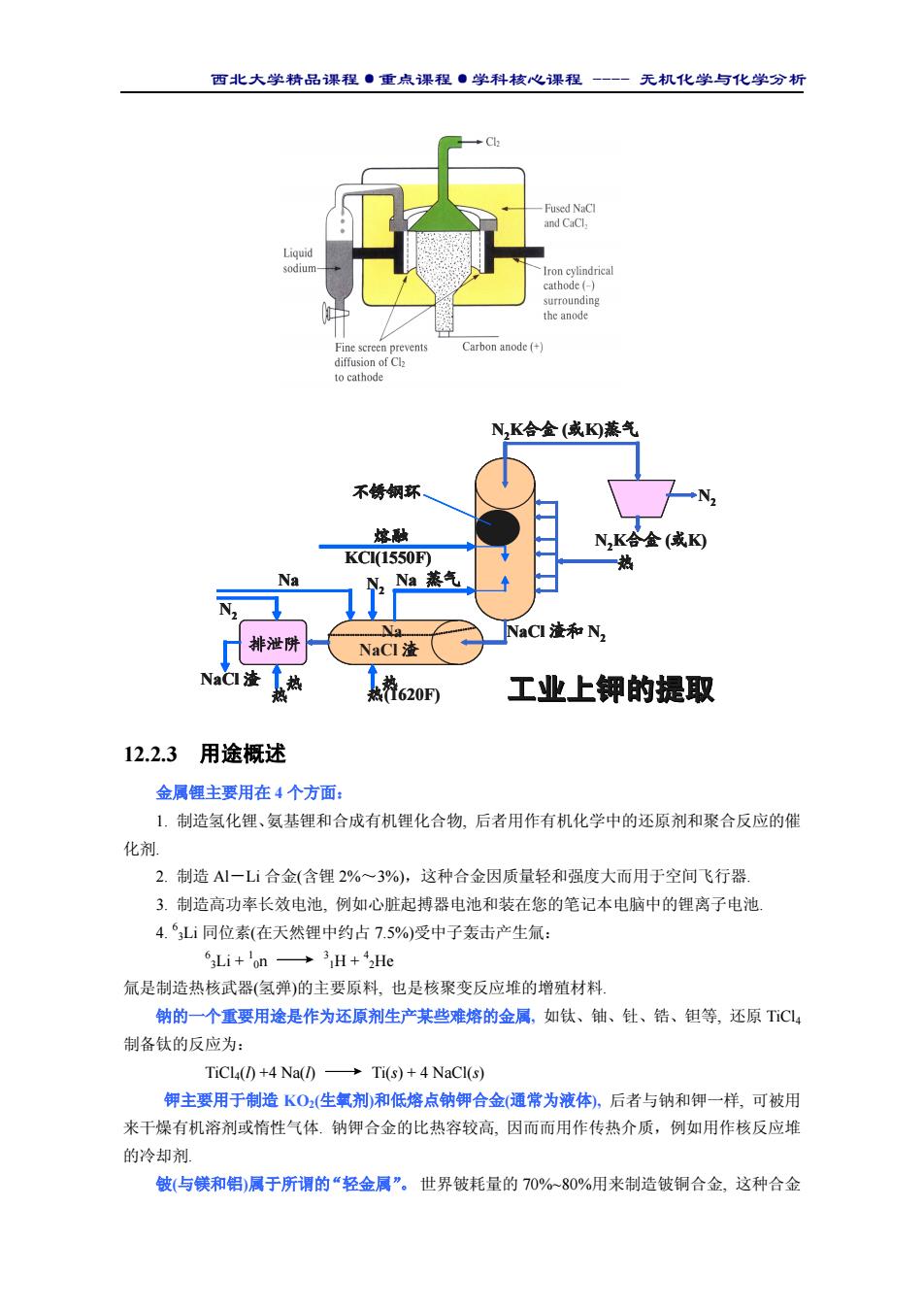
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 12.2.3 用途概述 金属锂主要用在 4 个方面: 1. 制造氢化锂、氨基锂和合成有机锂化合物, 后者用作有机化学中的还原剂和聚合反应的催 化剂. 2. 制造 Al-Li 合金(含锂 2%~3%),这种合金因质量轻和强度大而用于空间飞行器. 3. 制造高功率长效电池, 例如心脏起搏器电池和装在您的笔记本电脑中的锂离子电池. 4. 6 3Li 同位素(在天然锂中约占 7.5%)受中子轰击产生氚: 6 3Li + 1 0n 3 1H + 4 2He 氚是制造热核武器(氢弹)的主要原料, 也是核聚变反应堆的增殖材料. 钠的一个重要用途是作为还原剂生产某些难熔的金属, 如钛、铀、钍、锆、钽等, 还原 TiCl4 制备钛的反应为: TiCl4(l) +4 Na(l) Ti(s) + 4 NaCl(s) 钾主要用于制造 KO2(生氧剂)和低熔点钠钾合金(通常为液体), 后者与钠和钾一样, 可被用 来干燥有机溶剂或惰性气体. 钠钾合金的比热容较高, 因而而用作传热介质,例如用作核反应堆 的冷却剂. 铍(与镁和铝)属于所谓的“轻金属”。 世界铍耗量的 70%~80%用来制造铍铜合金, 这种合金 热 热(1620F) 热 N2K合金 (或K) N2 N2K合金 (或K)蒸气 排泄阱 Na NaCl 渣和 N2 NaCl 渣 KCl(1550F) 熔融 不锈钢环 NaCl 渣 N Na 蒸气 2 N2 Na 热热 热热(1620F) 工业上钾的提取 热 N2K合金 (或K) N2 N2K合金 (或K)蒸气 排泄阱 Na NaCl 渣和 N2 NaCl 渣 KCl(1550F) 熔融 不锈钢环 NaCl 渣 N Na 蒸气 2 N2 Na 热 N2K合金 (或K) N2 N2K合金 (或K)蒸气 排泄阱 Na NaCl 渣和 N2 NaCl 渣 KCl(1550F) 熔融 不锈钢环 NaCl 渣 N Na 蒸气 2 N2 Na 热 热 工业上钾的提取
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 12.2.3 用途概述 金属锂主要用在 4 个方面: 1. 制造氢化锂、氨基锂和合成有机锂化合物, 后者用作有机化学中的还原剂和聚合反应的催 化剂. 2. 制造 Al-Li 合金(含锂 2%~3%),这种合金因质量轻和强度大而用于空间飞行器. 3. 制造高功率长效电池, 例如心脏起搏器电池和装在您的笔记本电脑中的锂离子电池. 4. 6 3Li 同位素(在天然锂中约占 7.5%)受中子轰击产生氚: 6 3Li + 1 0n 3 1H + 4 2He 氚是制造热核武器(氢弹)的主要原料, 也是核聚变反应堆的增殖材料. 钠的一个重要用途是作为还原剂生产某些难熔的金属, 如钛、铀、钍、锆、钽等, 还原 TiCl4 制备钛的反应为: TiCl4(l) +4 Na(l) Ti(s) + 4 NaCl(s) 钾主要用于制造 KO2(生氧剂)和低熔点钠钾合金(通常为液体), 后者与钠和钾一样, 可被用 来干燥有机溶剂或惰性气体. 钠钾合金的比热容较高, 因而而用作传热介质,例如用作核反应堆 的冷却剂. 铍(与镁和铝)属于所谓的“轻金属”。 世界铍耗量的 70%~80%用来制造铍铜合金, 这种合金 热 热(1620F) 热 N2K合金 (或K) N2 N2K合金 (或K)蒸气 排泄阱 Na NaCl 渣和 N2 NaCl 渣 KCl(1550F) 熔融 不锈钢环 NaCl 渣 N Na 蒸气 2 N2 Na 热热 热热(1620F) 工业上钾的提取 热 N2K合金 (或K) N2 N2K合金 (或K)蒸气 排泄阱 Na NaCl 渣和 N2 NaCl 渣 KCl(1550F) 熔融 不锈钢环 NaCl 渣 N Na 蒸气 2 N2 Na 热 N2K合金 (或K) N2 N2K合金 (或K)蒸气 排泄阱 Na NaCl 渣和 N2 NaCl 渣 KCl(1550F) 熔融 不锈钢环 NaCl 渣 N Na 蒸气 2 N2 Na 热 热 工业上钾的提取