
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 1 第 17 章 氢 Chapter 17 Hydrogen 教学要求 1.熟悉镧系元素电子结构、名称,镧系收缩概念及其产生原因和影响; 2.了解镧系元素的存在,制备及用途; 3.重点掌握镧系元素氧化物,氢氧化物的性质; 4.了解镧系元素的分离方法,特别注意溶剂萃取法及离子交换法的原理; 5. 简单了解锕系元素电子结构、名称及与镧系元素的相似性。 课时分配(4 学时) 1. 氢的存在、制备及用途: (2 学时) 2. 二元氢化物的分类:(1 学时) 3. 氢能源: (1 学时) 氢是周期表中唯一尚未找到确切位置的元素。 ☆ 有时将其放在碱金属元素上方(与碱金属原子相同,都只有一个介电子), 但不论化学性质还是物理性质都不像碱金属,特别是它毕竟不是金属(人 们预料在很高的压力下氢会显示金属性,但实验室尚达不到这样的压力条 件)。 ☆ 有人主张将其放在卤素上方的格子内,理由是像卤素一样加合一个电子好 可达到稳定的稀有气体电子组态。氢的确显示出某些相似于卤素的性质, 但由 I2 至 F2 活泼性依次增高的性质显然不能延伸至 H2 分子。 17.1 存在、制备和用途 ★ 存在 氢是宇宙中丰度最高的元素,在地球上的丰度排在第 15 位。某些矿物(例如 石油、天然气)和水是氢的主要资源,大气中 H2 的含量很低是因为它太轻而容易脱离地球 引力场。 10 20 30 40 50 60 70 80 90 8 6 4 2 0 –2 Pb Bi Pb Th Xe Sc Fe O 原子序数 log(相 对 丰 度) 偶数Z 奇数Z 10 20 30 40 50 60 70 80 90 8 6 4 2 0 –2 Pb Bi Pb Th Xe Sc Fe O 原子序数 log(相 对 丰 度) 偶数Z 奇数Z
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 1 第 17 章 氢 Chapter 17 Hydrogen 教学要求 1.熟悉镧系元素电子结构、名称,镧系收缩概念及其产生原因和影响; 2.了解镧系元素的存在,制备及用途; 3.重点掌握镧系元素氧化物,氢氧化物的性质; 4.了解镧系元素的分离方法,特别注意溶剂萃取法及离子交换法的原理; 5. 简单了解锕系元素电子结构、名称及与镧系元素的相似性。 课时分配(4 学时) 1. 氢的存在、制备及用途: (2 学时) 2. 二元氢化物的分类:(1 学时) 3. 氢能源: (1 学时) 氢是周期表中唯一尚未找到确切位置的元素。 ☆ 有时将其放在碱金属元素上方(与碱金属原子相同,都只有一个介电子), 但不论化学性质还是物理性质都不像碱金属,特别是它毕竟不是金属(人 们预料在很高的压力下氢会显示金属性,但实验室尚达不到这样的压力条 件)。 ☆ 有人主张将其放在卤素上方的格子内,理由是像卤素一样加合一个电子好 可达到稳定的稀有气体电子组态。氢的确显示出某些相似于卤素的性质, 但由 I2 至 F2 活泼性依次增高的性质显然不能延伸至 H2 分子。 17.1 存在、制备和用途 ★ 存在 氢是宇宙中丰度最高的元素,在地球上的丰度排在第 15 位。某些矿物(例如 石油、天然气)和水是氢的主要资源,大气中 H2 的含量很低是因为它太轻而容易脱离地球 引力场。 10 20 30 40 50 60 70 80 90 8 6 4 2 0 –2 Pb Bi Pb Th Xe Sc Fe O 原子序数 log(相 对 丰 度) 偶数Z 奇数Z 10 20 30 40 50 60 70 80 90 8 6 4 2 0 –2 Pb Bi Pb Th Xe Sc Fe O 原子序数 log(相 对 丰 度) 偶数Z 奇数Z
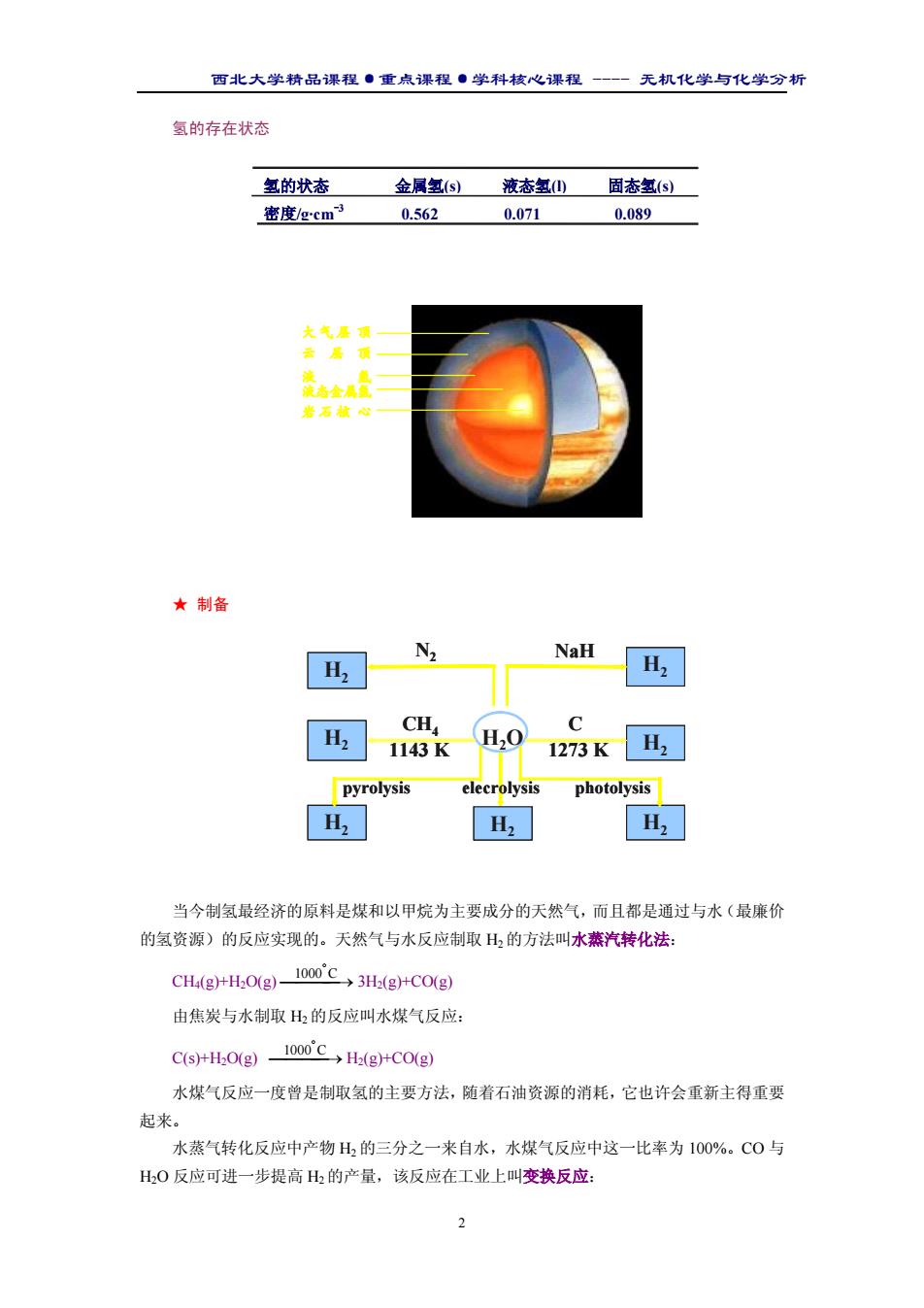
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 2 氢的存在状态 ★ 制备 当今制氢最经济的原料是煤和以甲烷为主要成分的天然气,而且都是通过与水(最廉价 的氢资源)的反应实现的。天然气与水反应制取 H2 的方法叫水蒸汽转化法: CH4(g)+H2O(g) → ° 1000 C 3H2(g)+CO(g) 由焦炭与水制取 H2 的反应叫水煤气反应: C(s)+H2O(g) → ° 1000 C H2(g)+CO(g) 水煤气反应一度曾是制取氢的主要方法,随着石油资源的消耗,它也许会重新主得重要 起来。 水蒸气转化反应中产物 H2 的三分之一来自水,水煤气反应中这一比率为 100%。CO 与 H2O 反应可进一步提高 H2 的产量,该反应在工业上叫变换反应: 氢的状态 金属氢(s) 液态氢(l) 固态氢(s) 密度/g·cm-3 0.562 0.071 0.089 大气层 顶 云层顶 液 氢 液态金属氢 岩石核 心 H2O H2 H2 H2 H2 H2 H2 H2 N2 NaH C 1273 K CH4 1143 K pyrolysis photolysis elecrolysis H2O H2 H2 H2 H2 H2 H2 H2 N2 NaH C 1273 K CH4 1143 K pyrolysis photolysis elecrolysis
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 2 氢的存在状态 ★ 制备 当今制氢最经济的原料是煤和以甲烷为主要成分的天然气,而且都是通过与水(最廉价 的氢资源)的反应实现的。天然气与水反应制取 H2 的方法叫水蒸汽转化法: CH4(g)+H2O(g) → ° 1000 C 3H2(g)+CO(g) 由焦炭与水制取 H2 的反应叫水煤气反应: C(s)+H2O(g) → ° 1000 C H2(g)+CO(g) 水煤气反应一度曾是制取氢的主要方法,随着石油资源的消耗,它也许会重新主得重要 起来。 水蒸气转化反应中产物 H2 的三分之一来自水,水煤气反应中这一比率为 100%。CO 与 H2O 反应可进一步提高 H2 的产量,该反应在工业上叫变换反应: 氢的状态 金属氢(s) 液态氢(l) 固态氢(s) 密度/g·cm-3 0.562 0.071 0.089 大气层 顶 云层顶 液 氢 液态金属氢 岩石核 心 H2O H2 H2 H2 H2 H2 H2 H2 N2 NaH C 1273 K CH4 1143 K pyrolysis photolysis elecrolysis H2O H2 H2 H2 H2 H2 H2 H2 N2 NaH C 1273 K CH4 1143 K pyrolysis photolysis elecrolysis
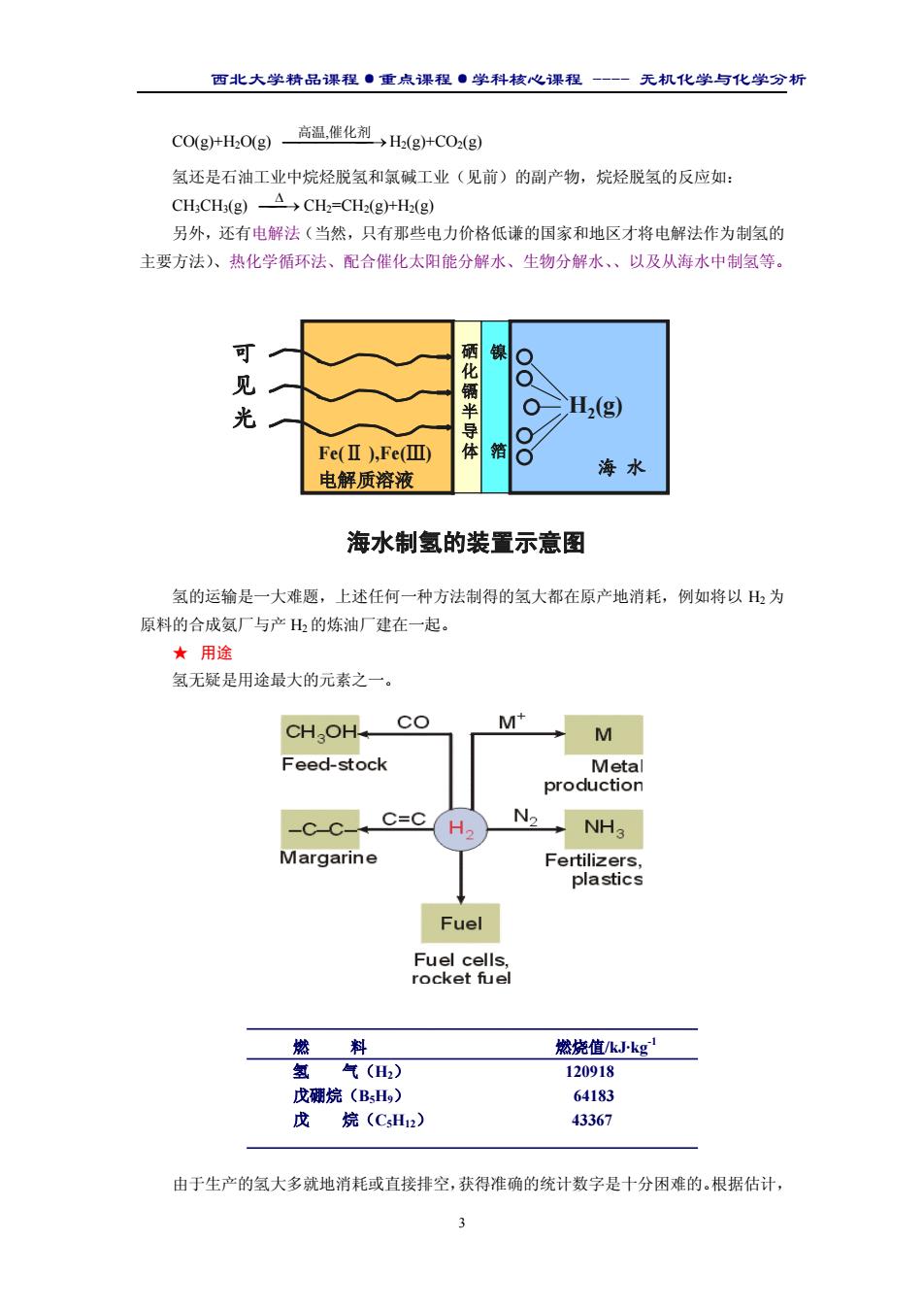
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 3 CO(g)+H2O(g) → 高温,催化剂 H2(g)+CO2(g) 氢还是石油工业中烷烃脱氢和氯碱工业(见前)的副产物,烷烃脱氢的反应如: CH3CH3(g) → ∆ CH2=CH2(g)+H2(g) 另外,还有电解法(当然,只有那些电力价格低谦的国家和地区才将电解法作为制氢的 主要方法)、热化学循环法、配合催化太阳能分解水、生物分解水、以及从海水中制氢等。 氢的运输是一大难题,上述任何一种方法制得的氢大都在原产地消耗,例如将以 H2 为 原料的合成氨厂与产 H2 的炼油厂建在一起。 ★ 用途 氢无疑是用途最大的元素之一。 由于生产的氢大多就地消耗或直接排空,获得准确的统计数字是十分困难的。根据估计, 燃 料 燃烧值/kJ·kg-1 氢 气(H2) 120918 戊硼烷(B5H9) 64183 戊 烷(C5H12) 43367 H2(g) 海 水 Fe(Ⅱ ),Fe(Ⅲ) 电解质溶液 硒 化 镉 半 导 体 镍 箔 可 见 光 海水制氢的装置示意图 H2(g) 海 水 Fe(Ⅱ ),Fe(Ⅲ) 电解质溶液 硒 化 镉 半 导 体 镍 箔 可 见 光 海水制氢的装置示意图
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 3 CO(g)+H2O(g) → 高温,催化剂 H2(g)+CO2(g) 氢还是石油工业中烷烃脱氢和氯碱工业(见前)的副产物,烷烃脱氢的反应如: CH3CH3(g) → ∆ CH2=CH2(g)+H2(g) 另外,还有电解法(当然,只有那些电力价格低谦的国家和地区才将电解法作为制氢的 主要方法)、热化学循环法、配合催化太阳能分解水、生物分解水、以及从海水中制氢等。 氢的运输是一大难题,上述任何一种方法制得的氢大都在原产地消耗,例如将以 H2 为 原料的合成氨厂与产 H2 的炼油厂建在一起。 ★ 用途 氢无疑是用途最大的元素之一。 由于生产的氢大多就地消耗或直接排空,获得准确的统计数字是十分困难的。根据估计, 燃 料 燃烧值/kJ·kg-1 氢 气(H2) 120918 戊硼烷(B5H9) 64183 戊 烷(C5H12) 43367 H2(g) 海 水 Fe(Ⅱ ),Fe(Ⅲ) 电解质溶液 硒 化 镉 半 导 体 镍 箔 可 见 光 海水制氢的装置示意图 H2(g) 海 水 Fe(Ⅱ ),Fe(Ⅲ) 电解质溶液 硒 化 镉 半 导 体 镍 箔 可 见 光 海水制氢的装置示意图

西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 4 全世界每年一产的氢接近 500×109 m 3 。 较低的质量和高燃烧焓使氢成为大型火箭的理想 燃料。20 世纪 70 年代初石油价格猛涨的那段时间内, 科学家严肃地论证过用氢做普通燃料的前景,并提出 了“氢经济学”(hdrogen economy)设想方案。方案 之一是利用太阳能获得谦价的电力电解水,实际是贮 存并利用太阳能的一种方式。虽然“氢经济学”方案 目前不可行(由石油、天然气和煤制取氢的成本要低 得多),但社会对氢能源的注意力仍然不减。世界氢能 源会议从 20 世纪 70 年代中期开始每两年举行一次,吸 引着众多科学家与会。 17.2 核性质 ★ 同位素 氢有三种同位素,它们的质是数分别为 1,2 和 3。 与氢以水的形式存在相似,重氢以重水(D2O)形式存在于天然水中。各种天然水中重 氢的丰度不尽相同,平均约占氢原子总数的 0.016%。 ★ 制备 氚在表面水中的丰度极低,每 1021 个 H 氢原子中才有 1 个氚原子。核聚变反 应中用的氚是从中子轰击锂靶的裂变反应堆中合成的: n Li He H3 1 4 2 6 3 1 0 + → + ★ 同位素效应 一般情况下不同同位素形成的同型分子表现出极为相似的物理和化学 性质,例如 10BF3 与 11BF3 的键焓、蒸气压和路易斯酸性几乎相等。然而,质量相对差特大 的氢同位素物种却出现另一种情况。 D2O 的沸点明显高于 H2O,这是由于前者形成的氢键(O.D—O)比后者(O.H—O) 更强些。相同化学环境下 E—D 键焓高于 E—H 键焓的现象在很大程度上是由零点能的差别 引起的。第 2 章介绍过类似的势能曲线,这里同时示出了零点能。零点能低时键焓相对比较 高,而零点能高时键焓相对比较低。氢同位素造成的性质差别大得足以找到某些实际应用。 例如由于 D2O 中 D—O 键的键焓相对比较高,电解速率应当低于 H2O,其结果是 D2O 在电 ★氢燃烧速率快,反应完全. 氢能源是清洁能源,没有环 境污染,能保持生态平衡. ★ 目前,已实验成功用氢作动力的汽车,有望不久能投入 实用 氢作为航天飞机的燃料已经成为现实,有的航天飞机的 液态氢储罐存有近 1 800 m3 的液态氢 ★氢能源研究面临的三大问题: 氢气的发生(降低生产成本) 氢气的储 存
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 4 全世界每年一产的氢接近 500×109 m 3 。 较低的质量和高燃烧焓使氢成为大型火箭的理想 燃料。20 世纪 70 年代初石油价格猛涨的那段时间内, 科学家严肃地论证过用氢做普通燃料的前景,并提出 了“氢经济学”(hdrogen economy)设想方案。方案 之一是利用太阳能获得谦价的电力电解水,实际是贮 存并利用太阳能的一种方式。虽然“氢经济学”方案 目前不可行(由石油、天然气和煤制取氢的成本要低 得多),但社会对氢能源的注意力仍然不减。世界氢能 源会议从 20 世纪 70 年代中期开始每两年举行一次,吸 引着众多科学家与会。 17.2 核性质 ★ 同位素 氢有三种同位素,它们的质是数分别为 1,2 和 3。 与氢以水的形式存在相似,重氢以重水(D2O)形式存在于天然水中。各种天然水中重 氢的丰度不尽相同,平均约占氢原子总数的 0.016%。 ★ 制备 氚在表面水中的丰度极低,每 1021 个 H 氢原子中才有 1 个氚原子。核聚变反 应中用的氚是从中子轰击锂靶的裂变反应堆中合成的: n Li He H3 1 4 2 6 3 1 0 + → + ★ 同位素效应 一般情况下不同同位素形成的同型分子表现出极为相似的物理和化学 性质,例如 10BF3 与 11BF3 的键焓、蒸气压和路易斯酸性几乎相等。然而,质量相对差特大 的氢同位素物种却出现另一种情况。 D2O 的沸点明显高于 H2O,这是由于前者形成的氢键(O.D—O)比后者(O.H—O) 更强些。相同化学环境下 E—D 键焓高于 E—H 键焓的现象在很大程度上是由零点能的差别 引起的。第 2 章介绍过类似的势能曲线,这里同时示出了零点能。零点能低时键焓相对比较 高,而零点能高时键焓相对比较低。氢同位素造成的性质差别大得足以找到某些实际应用。 例如由于 D2O 中 D—O 键的键焓相对比较高,电解速率应当低于 H2O,其结果是 D2O 在电 ★氢燃烧速率快,反应完全. 氢能源是清洁能源,没有环 境污染,能保持生态平衡. ★ 目前,已实验成功用氢作动力的汽车,有望不久能投入 实用 氢作为航天飞机的燃料已经成为现实,有的航天飞机的 液态氢储罐存有近 1 800 m3 的液态氢 ★氢能源研究面临的三大问题: 氢气的发生(降低生产成本) 氢气的储 存
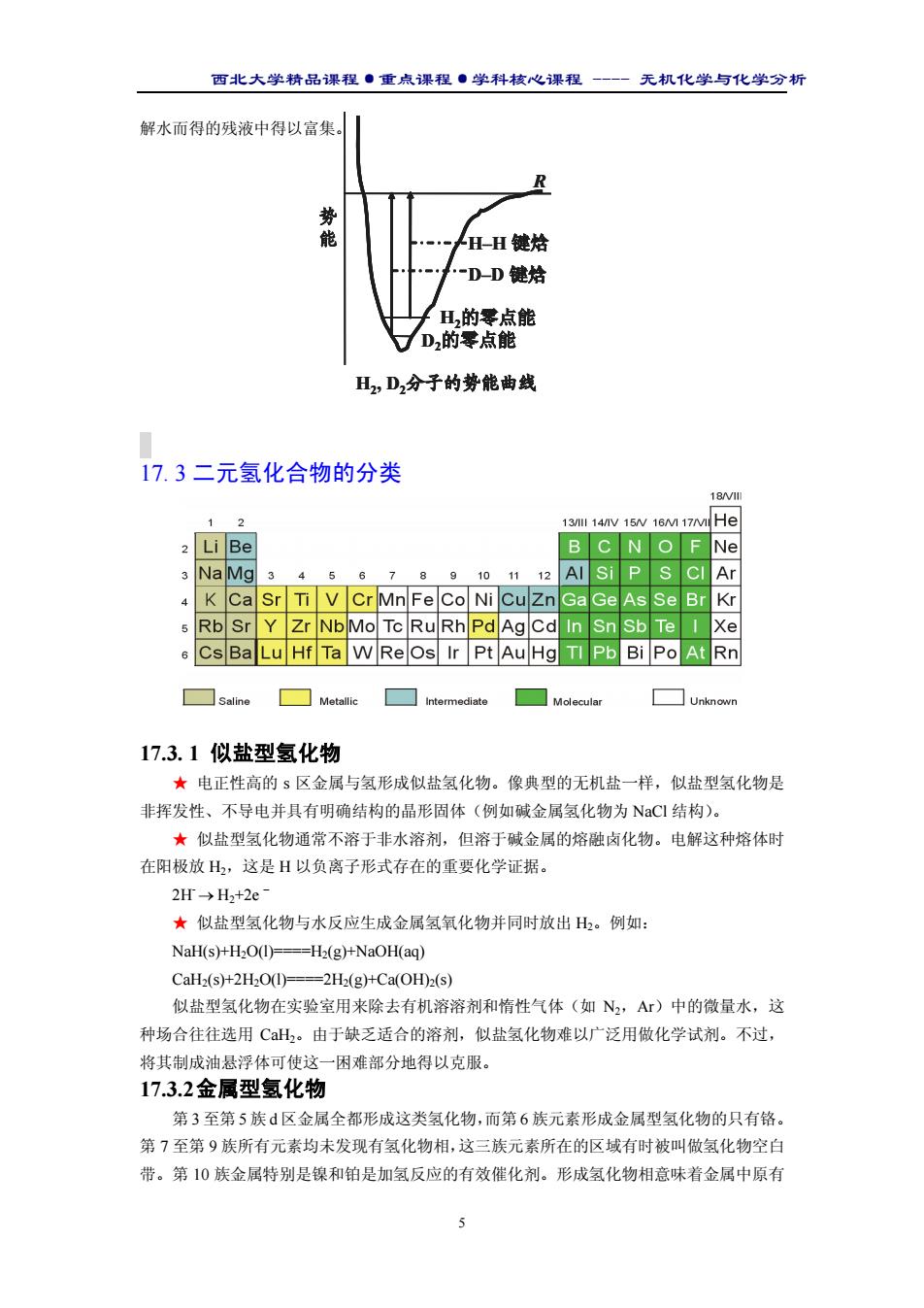
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 5 解水而得的残液中得以富集。 17. 3 二元氢化合物的分类 17.3. 1 似盐型氢化物 ★ 电正性高的 s 区金属与氢形成似盐氢化物。像典型的无机盐一样,似盐型氢化物是 非挥发性、不导电并具有明确结构的晶形固体(例如碱金属氢化物为 NaCl 结构)。 ★ 似盐型氢化物通常不溶于非水溶剂,但溶于碱金属的熔融卤化物。电解这种熔体时 在阳极放 H2,这是 H 以负离子形式存在的重要化学证据。 2H- → H2+2e – ★ 似盐型氢化物与水反应生成金属氢氧化物并同时放出 H2。例如: NaH(s)+H2O(l)====H2(g)+NaOH(aq) CaH2(s)+2H2O(l)====2H2(g)+Ca(OH)2(s) 似盐型氢化物在实验室用来除去有机溶溶剂和惰性气体(如 N2,Ar)中的微量水,这 种场合往往选用 CaH2。由于缺乏适合的溶剂,似盐氢化物难以广泛用做化学试剂。不过, 将其制成油悬浮体可使这一困难部分地得以克服。 17.3.2 金属型氢化物 第 3 至第 5 族 d 区金属全都形成这类氢化物,而第 6 族元素形成金属型氢化物的只有铬。 第 7 至第 9 族所有元素均未发现有氢化物相,这三族元素所在的区域有时被叫做氢化物空白 带。第 10 族金属特别是镍和铂是加氢反应的有效催化剂。形成氢化物相意味着金属中原有 势 能 H–H 键焓 D–D 键焓 H2的零点能 D2的零点能 H2, D2分子的势能曲线 R 势 能 H–H 键焓 D–D 键焓 H2的零点能 D2的零点能 H2, D2分子的势能曲线 R H–H 键焓 D–D 键焓 H2的零点能 D2的零点能 H2, D2分子的势能曲线 R
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 5 解水而得的残液中得以富集。 17. 3 二元氢化合物的分类 17.3. 1 似盐型氢化物 ★ 电正性高的 s 区金属与氢形成似盐氢化物。像典型的无机盐一样,似盐型氢化物是 非挥发性、不导电并具有明确结构的晶形固体(例如碱金属氢化物为 NaCl 结构)。 ★ 似盐型氢化物通常不溶于非水溶剂,但溶于碱金属的熔融卤化物。电解这种熔体时 在阳极放 H2,这是 H 以负离子形式存在的重要化学证据。 2H- → H2+2e – ★ 似盐型氢化物与水反应生成金属氢氧化物并同时放出 H2。例如: NaH(s)+H2O(l)====H2(g)+NaOH(aq) CaH2(s)+2H2O(l)====2H2(g)+Ca(OH)2(s) 似盐型氢化物在实验室用来除去有机溶溶剂和惰性气体(如 N2,Ar)中的微量水,这 种场合往往选用 CaH2。由于缺乏适合的溶剂,似盐氢化物难以广泛用做化学试剂。不过, 将其制成油悬浮体可使这一困难部分地得以克服。 17.3.2 金属型氢化物 第 3 至第 5 族 d 区金属全都形成这类氢化物,而第 6 族元素形成金属型氢化物的只有铬。 第 7 至第 9 族所有元素均未发现有氢化物相,这三族元素所在的区域有时被叫做氢化物空白 带。第 10 族金属特别是镍和铂是加氢反应的有效催化剂。形成氢化物相意味着金属中原有 势 能 H–H 键焓 D–D 键焓 H2的零点能 D2的零点能 H2, D2分子的势能曲线 R 势 能 H–H 键焓 D–D 键焓 H2的零点能 D2的零点能 H2, D2分子的势能曲线 R H–H 键焓 D–D 键焓 H2的零点能 D2的零点能 H2, D2分子的势能曲线 R