
化学性质 1.与金属、非金属反应 卤素单质的氧化性是其最典型的化学性质。 F2>Cl>Br2>I2 F2:能和所有的金属和非金属(氮、氧和一些稀 有气体外)直接化合,猛烈、燃烧和爆炸,氧化 为最高氧化态。 。C2:和氟类似,多数需加热,剧烈程度不如氟。 。Br2,2:难与贵金属反应,与其他金属或者非 金属反应需高温,氧化态低
化学性质 ⚫ 1.与金属、非金属反应 卤素单质的氧化性是其最典型的化学性质。 F2> Cl2 > Br2 > I2 ⚫ F2:能和所有的金属和非金属(氮、氧和一些稀 有气体外)直接化合,猛烈、燃烧和爆炸,氧化 为最高氧化态。 ⚫ Cl2:和氟类似,多数需加热,剧烈程度不如氟. ⚫ Br2 ,I2 :难与贵金属反应,与其他金属或者非 金属反应需高温,氧化态低

2.与水的反应 卤素与水可能发生两类反应 X2+H20=2H+2X+ 2 X2+H,O→H+X+HXO 。上式为氧的置换反应,氟与水剧烈反应,氯需 光照,溴缓慢反应,碘无法置换氧,却能被氧 置换。 ·下式为歧化反应,是氯溴碘与水的主要反应式
2. 与水的反应 ⚫ 卤素与水可能发生两类反应 ⚫ 上式为氧的置换反应,氟与水剧烈反应,氯需 光照,溴缓慢反应,碘无法置换氧,却能被氧 置换。 ⚫ 下式为歧化反应,是氯溴碘与水的主要反应式
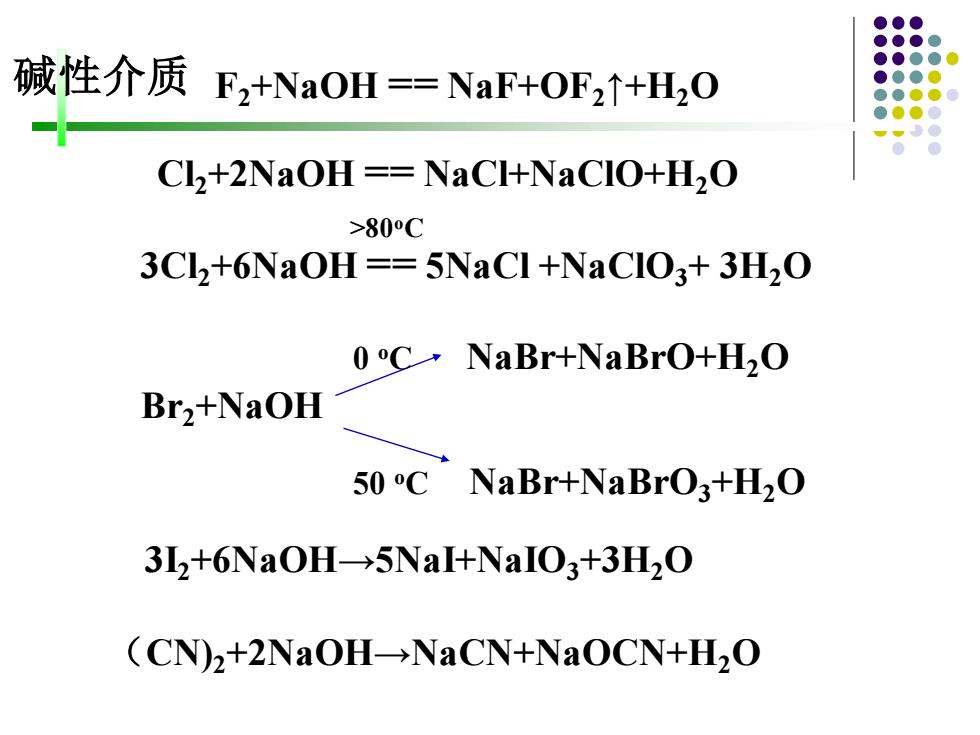
碱性介质F2+NaOH=NaF+OF2+H0 CL+2NaOH ==NaCl+NaCIO+H2O >800C 3Cl,+6NaOH==5NaCl +NaCIO3+3H2O 0C·NaBr+NaBro+HzO Br2+NaOH 50 C NaBr+NaBrO3+H2O 3I,+6NaOH-5NaI+NaIO3+3H2O (CN)2+2NaOH-NaCN+NaOCN+H2O
F2+NaOH == NaF+OF2↑+H2O (CN)2+2NaOH→NaCN+NaOCN+H2O Cl2+2NaOH == NaCl+NaClO+H2O Br2+NaOH 50 oC NaBr+NaBrO3+H2O 0 oC NaBr+NaBrO+H2O 3I2+6NaOH→5NaI+NaIO3+3H2O >80oC 3Cl2+6NaOH == 5NaCl +NaClO3+ 3H2O 碱性介质

3.卤素之间的置换反应: ● 氧化能力:F2>Cl2>Br2>I2 ●还原能力:I->B>C>F 。按F-C-B-I的次序,前面的卤素单质可以将后面的 卤素从其卤化物中置换出来。 CL +2Br =2CI +B CL +21=2CT +1, Br +21=2Br+1
3. 卤素之间的置换反应: ⚫ 氧化能力: F2 > Cl2 > Br2 > I2 ⚫ 还原能力: I- > Br-> Cl- > F- ⚫ 按F-Cl-Br-I的次序,前面的卤素单质可以将后面的 卤素从其卤化物中置换出来。 2 2 2 2 2 2 2 2 2 2 2 2 Br I Br I Cl I Cl I Cl Br Cl Br + = + + = + + = + − − − − − −

卤素单质的制备和用途 。制备路线:2X→X2 (X=F,CL,Br,D) 2I03→L2 。1.F2的制备:°(F2/F)=2.87V ()电解法:欲使F→F2,只能用最强的还原方法一电解法 电解质:氟氢化钾(KHF2)+氟化氢HF) 阳极(氧化反应):石墨,2F-2e=F2 阴极(还原反应):钢,2HF2+2e=H2+4F 电解过程中不断加HFD。 95~100C,阴极与阳极用合金钢板隔开,避免F2和H2 相遇发生爆炸。贮运因难:氟冷却到203K并通过NaF洗 涤,钢瓶中运输与储存
卤素单质的制备和用途 ⚫ 制备路线: 2X- → X2 (X = F, Cl, Br, I) 2IO3 - → I2 ⚫ 1.F2的制备: (F2 / F- ) = 2.87 V (1)电解法:欲使F -→F2,只能用最强的还原方法—电解法 电解质:氟氢化钾(KHF2 ) + 氟化氢(HF) 阳极(氧化反应):石墨,2F- -2e = F2 阴极(还原反应):钢, 2HF2 - +2e = H2 + 4F- 电解过程中不断加(HF) 。 95~100C, 阴极与阳极用合金钢板隔开,避免F2和H2 相遇发生爆炸。贮运困难:氟冷却到203 K并通过NaF洗 涤,钢瓶中运输与储存