
Fe3+是中等强度氧化剂,如硫酸铁。 2Fe3++Cu→Cu2++2Fe2+ 2Fe3t+Fe→3Fe2+ 2Fe3++Sn2+>Sn++2Fe2+ 2Fe3++H,S>2Fe2++S+2H 2Fe(OH)3+3CIO-+40H-> 2FeO子+3C1+5H,0 红
Fe3+是中等强度氧化剂,如硫酸铁。 2FeO 3Cl 5H O 2Fe(OH) 3ClO 4OH 2 2 4 3 + + + + ⎯→ - - - - + + + 2Fe + H S ⎯→2Fe +S+ 2H 2 2 3 + + + + + ⎯→ + 3 2 4 2 2Fe Sn Sn 2Fe + ⎯→ + + 3 2 2Fe Fe 3Fe + + + + ⎯→ + 3 2 2 2Fe Cu Cu 2Fe 红
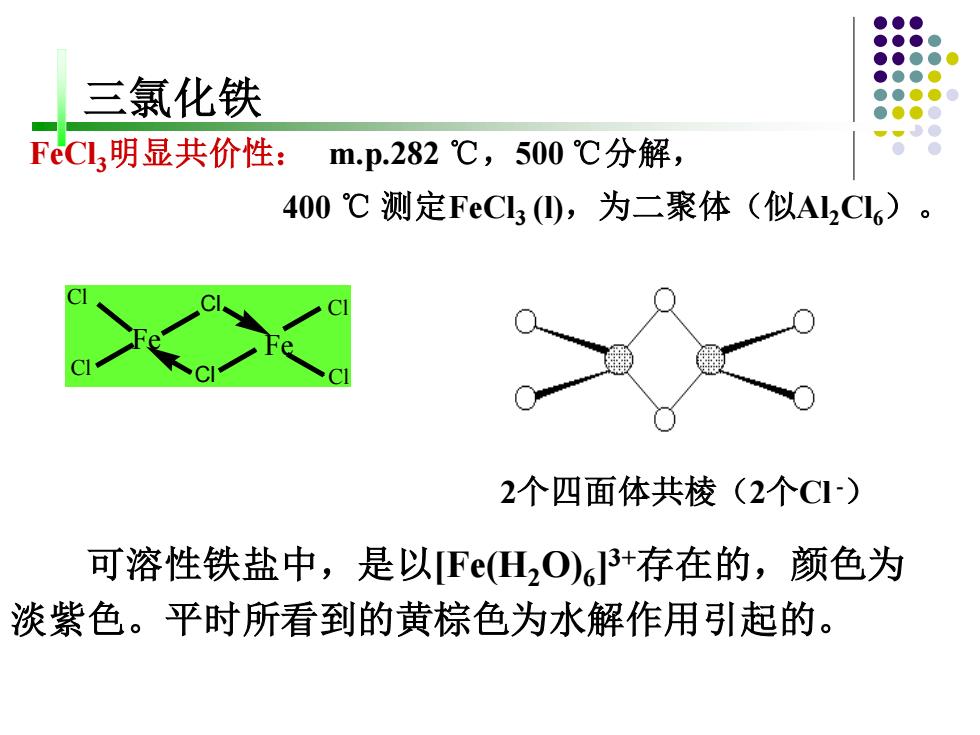
三氯化铁 FeCl3明显共价性: mp.282℃,500℃分解, 400℃测定FeCl3),为二聚体(似Al2C6)。 2个四面体共棱(2个CI) 可溶性铁盐中,是以F(H,O)63+存在的,颜色为 淡紫色。平时所看到的黄棕色为水解作用引起的
三氯化铁 FeCl3明显共价性: m.p.282 ℃,500 ℃分解, 400 ℃ 测定FeCl3 (l),为二聚体(似Al2Cl6)。 Cl Cl Cl Cl Cl Cl Fe Fe 2个四面体共棱(2个Cl -) 可溶性铁盐中,是以[Fe(H2O)6 ] 3+存在的,颜色为 淡紫色。平时所看到的黄棕色为水解作用引起的
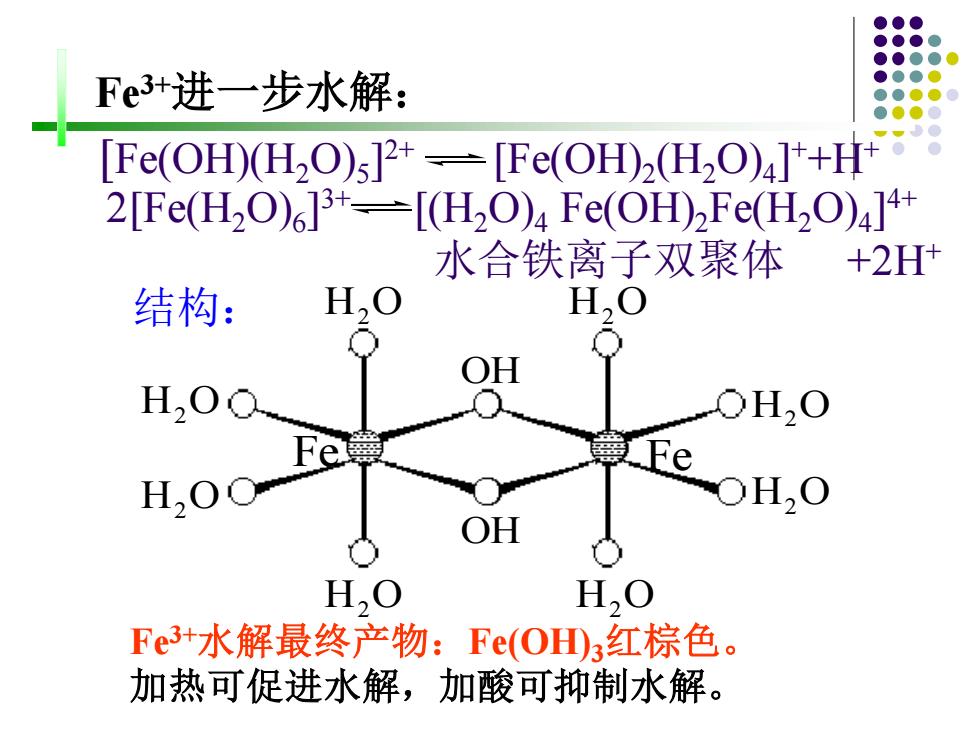
Fe3+进一步水解: [Fe(OH)(H2O)s]2+-[Fe(OH)2(H2O)]++H+ 2[Fe(H2O)6]3t=[H2O)4Fe(OH)2Fe(H2O)4]4+ 水合铁离子双聚体 +2H 结构: H,O H,O H,O OH,O Fe Fe OH H,O H,O Fe3+水解最终产物:Fe(O3红棕色。 加热可促进水解,加酸可抑制水解
Fe3+水解最终产物:Fe(OH)3红棕色。 加热可促进水解,加酸可抑制水解。 H2 O OHOH Fe H2 O H2 O H2 O H2 O H2 O H2 O H2 O Fe [Fe(OH)(H2O)5 ] 2+ [Fe(OH)2 (H2O)4 ] ++H+ 结构: 2[Fe(H2O)6 ] 3+ [(H2O)4 Fe(OH)2Fe(H2O)4 ] 4+ 水合铁离子双聚体 +2H+ Fe3+进一步水解:

Cr3+、A3+、Fe3+有许多相似之处: 1、水合离子都为6配位的。 2、易形成矾。如黄铁矾,明矾,铬钾矾。 3、氢氧化物为胶状沉淀。 Cr3+(62pm)、A3+(51pm)、Fe3+(64pm) 区别: 1、氢氧化物的两性。 2、氨配合物。 Fe3+与S2-作用产物与溶液的酸度有关。 中性或碱性为Fe,S3,酸性会有疏单质析出
Fe3+与S 2-作用产物与溶液的酸度有关。 中性或碱性为Fe2S3,酸性会有硫单质析出。 Cr3+ 、Al3+ 、Fe3+有许多相似之处: 1、水合离子都为6配位的。 2、易形成矾。如黄铁矾,明矾,铬钾矾。 3、氢氧化物为胶状沉淀。 Cr3+(62 pm)、Al3+(51 pm) 、Fe3+(64 pm) 区别: 1、氢氧化物的两性。 2、氨配合物
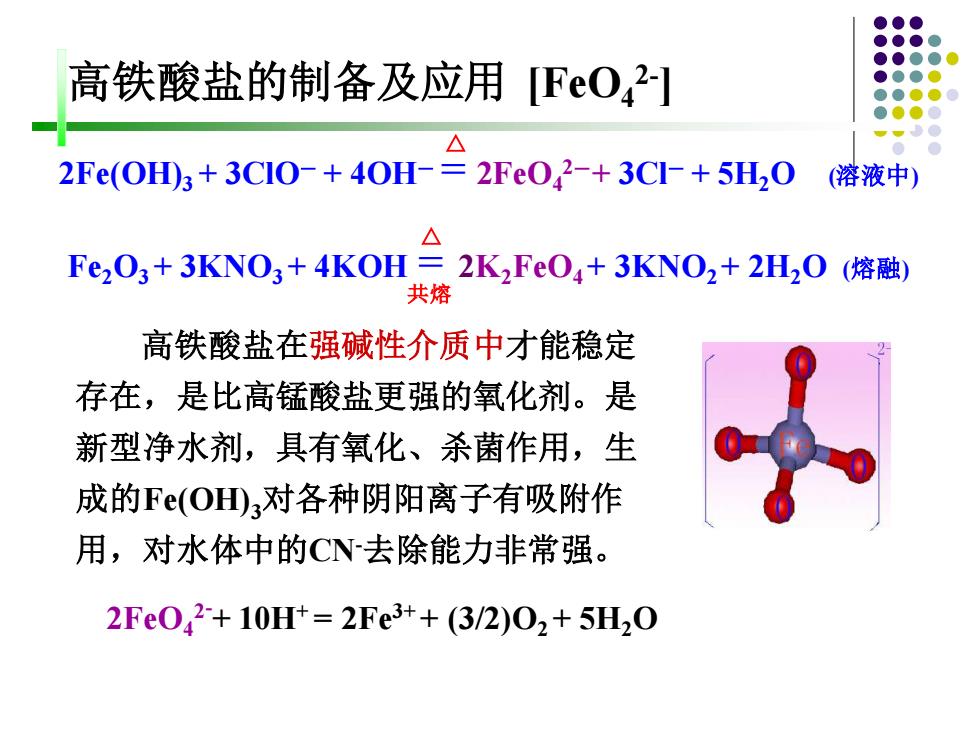
高铁酸盐的制备及应用Fe042] 2Fe(OH)3+3CI0-+40H-=2Fe0,2-+3CI-+5H,0 (溶液中) Fe2O3+3KNO3+4KOH三2K2FeO4+3KNO2+2H0(熔融) 共熔 高铁酸盐在强碱性介质中才能稳定 存在,是比高锰酸盐更强的氧化剂。是 新型净水剂,具有氧化、杀菌作用,生 成的Fe(OD)3对各种阴阳离子有吸附作 用,对水体中的CN去除能力非常强。 2Fe042+10Ht=2Fe3++(3/2)02+5H20
高铁酸盐的制备及应用 [FeO4 2- ] △ 2Fe(OH)3 + 3ClO- + 4OH- = 2FeO4 2-+ 3Cl- + 5H2O (溶液中) △ Fe2O3 + 3KNO3 + 4KOH = 2K2FeO4 + 3KNO2 + 2H2O (熔融) 共熔 2FeO4 2- + 10H+ = 2Fe3+ + (3/2)O2 + 5H2O 高铁酸盐在强碱性介质中才能稳定 存在,是比高锰酸盐更强的氧化剂。是 新型净水剂,具有氧化、杀菌作用,生 成的Fe(OH)3对各种阴阳离子有吸附作 用,对水体中的CN-去除能力非常强