
第七章 醇酚醚 教学目标: 1. 运用前面讲过的消除反应的历程和反应规律(查依采夫规律)分析醇的消除反应进 行的情况。 个别化合物可以通过分类和物理性质的讲解结合进行。 教学重点、难点: 醇的化学性质。包括醇似水性,脂化反应,亲核取代、消除及氧化反应。酚和醚重点讲 授分子结构与性质的关系。 教学方法、手段:讲授、CAI课件辅助教学。 本章学时:5学时

教学内容: 醇、酚、醚 醇、酚、醚是烃的含氧衍生物之一。醇和酚的分子中均含有羟基(一OH)官能团。羟基 直接与脂肪烃基相连的是醇类化合物,直接与芳基相连的是酚类化合物。例如: OH CH2OH CH3CH2OH 醇 酚 醚是氧原子直接与两个烃基相连的化合物(RO一R、ArO一Ar或R一O一Ar),通常 是山醇或酚制得,是醇或酚的官能团异构体。 第一节醇 醇是脂肪烃分子中的氢原子被羟基(OH)取代的衍尘物,也可看作是水中的氢原子被 脂肪烃基取代的产物。 一,醇的分类和命名 1.醇的分类 根据羟基所连烃基的结构,可把醇分为脂肪醇、脂环醇、芳香醇(羟基连在芳烃侧链上的 醇)等。例如: CH2CH20H CH3CH20H OH 脂肪醇 脂环醇 芳香醇 根据羟基所连烃基的饱和程度,可把醇分为饱和醇和不饱和醇。例: CH3CHCH3 CH2=CH-CH2OH OH 饱和醇 不饱和醇 根据分子中羟基的数目,可把醇分为一元醇、二元醇和多元醇。饱和一元醇的通式为 CH2m+20。在二元醇中,两个羟基连在相邻碳原子上的称为邻二醇,两个羟基连在同一碳原子 上的称为胞二醇(不稳定)。例如: CH2CH2CH2 CH2一CH2 CH:CH2CH2OH OH OH OH OH 一心醇 元醇 元醇(邻二醇) 根据羟基所连碳原子的类型,可把醇分为伯醇(一级醇)、仲醇(二级醇)和叔醇(三 级醇)。例: R' 1 RCH,OH RCH2- CH-R' R-C-R OH OH 伯醇(一级醇) 仲醇(级醇) 叔醇(三级醇
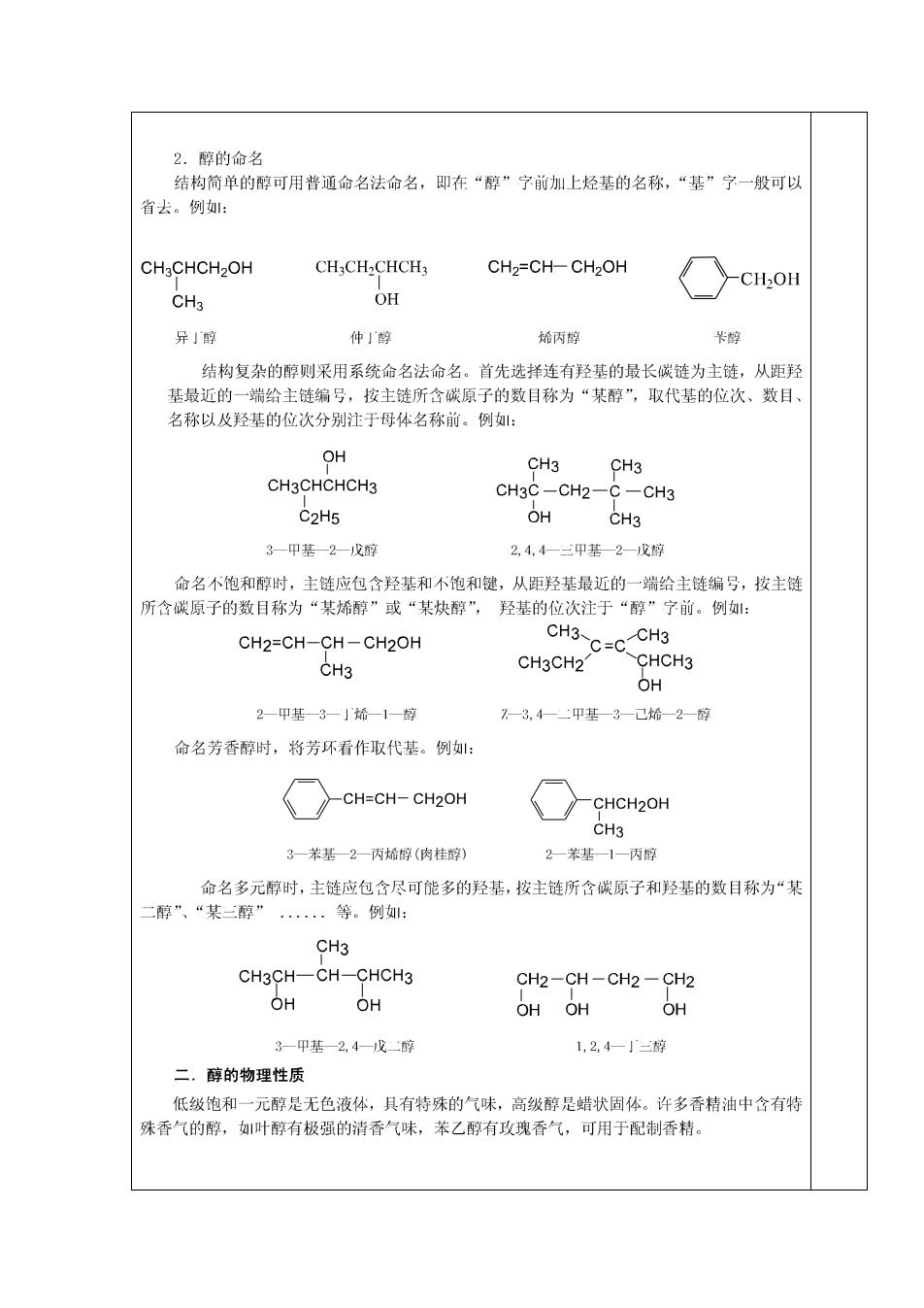
2.醇的命名 结构简单的醇可用普通命名法命名,即在“醇”宁前加上烃基的名称,“基”宁一般可以 省去。例: CH3CHCH2OH CH3CH2CHCH3 CH2=CH-CH2OH CH2OH CH3 OH 异」醇 仲」醇 烯丙醇 卡醇 结构复杂的醇则采用系统命名法命名。首先选择连有羟基的最长碳链为主链,从距羟 基最近的一端给主链编号,按主链所含碳原子的数目称为“某醇”,取代基的位次、数目、 名称以及羟基的位次分别注于母体名称前。例: OH CH3 CH3 CH3CHCHCH3 CH3C-CH2-C-CH3 C2H5 OH CH3 3一甲基一2戊醇 2,4,4一三甲基—2一戊醇 命名不饱和醇时,主链应包含羟基和不饱和键,从距羟基最近的一端给主链编号,按主链 所含碳原子的数目称为“某烯醇”或“某炔醇”,羟基的位次注于“醇”宁前。例如: CH2=CH-CH-CH2OH C=CCH3 CH3 CH3 CH3CH2 CHCH3 OH 2一甲基3一」烯一1醇 7一3,4一甲基—3一已烯一2一醇 命名芳香醇时,将芳环看作取代基。例: CH=CH-CH2OH CHCH20H CH3 3一苯基一2一丙烯醇(肉桂醇) 2一苯基一1—丙醇 命名多元醇时,主链应包含尽可能多的羟基,按主链所含碳原子和羟基的数目称为“某 二醇”、“某三醇” 等。例: CH3 CH3CH-CH-CHCH3 CH2-CH-CH2-CH2 OH OH OHOH OH 3-甲基一2,4一戊二醇 1,2,4一三醇 二。醇的物理性质 低级饱和一元醇是无色液体,具有特殊的气味,高级醇是蜡状固体。许多香精油中含有特 殊香气的醇,叶醇有极强的清香气味,苯乙醇有政瑰香气,可用于配制香精

H一H CH2CH20H C=C CH3CH2 CH2CH20H 叶醇 2一苯乙醇 山于含有羟基,醇分子间可以形成氢键,所以醇的沸点不但高于分子量相近的烃,也高于 分子量相近的卤代烃。随着分子量的增加,醇的沸点有规律地升高,每增加一个CH2,沸点升 高约18~20℃。碳原子数相同的醇,支链越多沸点越低。醇分子中羟基数目增多,分子间能 形成史多的氢键,沸点也就史高。 羟基能与水形成健,是亲水基团,而烃基是不溶于水的疏水基团,所以在分子中引入羟基能 增加化合物的水溶性。C,~C;的一元醇,山于羟基在分子中所占的比例较大,可与水任意混 溶。C4~C,的一元醇,山于疏水基团所占比例越来越大,在水中的溶解度迅速降低。C1o以上的 元醇则难溶于水。一些常见醇的物理常数见表6-1。 一些低级醇1甲醇、乙醇等,能和某些无机盐(MgCl2、CaCl2、CuSO4等)形成结品状的 化合物,称为结品醇,1MgC12·6CHOH、CaCl2·4CHOH、CaCl2·4CH,OH等。结品醇 溶于水而不溶于有机溶剂,所以不能用无水CC12来除去甲醇、乙醇等中的水分。但利用这一 性质,可将醇与其他有机物分离开来。 三.醇的化学性质 化合物的性质主要是山其分子的结构决定的。羟基是醇类化合物的官能团,羟基中的氧原 子为不等性p杂化,其中两个p杂化轨道被两对未共用电子对占据,余下的两个p杂化轨 道分别与碳原子和氢原子形成C一O键和C一H键。 R H 醇分子中氧的价健及未共用电子对分布示意图 山于氧原子的电负性比碳原子和氢原子大,因此氧原子上的电子云密度偏高,易于接受质 子,或作为亲核试剂发生某些化学反应。醇分子中的碳氧键和氧氢键均为较强的极性键,在 定条件下易发生键的断裂,碳氧键断裂能发生亲核取代反应或消除反应,氧氢键断裂能发生脂 化反应。山于羟基吸电子诱导效应的影响,增强了·H原子和BH原子的活性,易于发生a H的氧化和BH的消除反应。综上所述,可归纳出醇的主要化学性质下: (H)R a-H的氧化 R、 CH- 取代反应 H 醇的弱酸性 酯化反应 消除反应(分子内脱水) 在反应中,反应的部位取决于所用的试剂和反应的条件,反应活性则取决于烃基的结构。 1.与活泼金属的反应 与水相似,醇羟基上的氢与活泼金属1N、K、Mg、A1等反应放出氢气,表现出一定的 酸性,但比水要缓和得多

2H20+2Na一一2OH+H2↑(反应激烈) 2CH3CH2OH+2Na一→2C2H,ONa+H2↑(反应缓和) 乙醇钠 6(CH3)2CHOH+2A1-一2[(CH3)2CHO]3A1+3H2↑ 异丙醇侣 2CH3CH2CH2OH+Mg一一(CH,CH2CH2O2Mg+H2t 丙醇镁 这主要是山于醇分子中的烃基具有斥电子诱导效应(+),使氧氢键的极性比水弱所 致。羟基ā-碳上的烷基增多,氧氢键的极性相应地域弱,所以不同烃基结构的醇与活泼金属 反应的活性次序为: 水>甲醇>伯醇>仲醇>叔醇 山于醇的酸性比水弱,其共轭碱烷氧基(RO)的碱性就比OH强,所以醇盐遇水会分 解为醇和金属氢氧化物: RCH2ONa +H2O-RCH2OH+NaOH 在有机反应中,烷氧基既可作为碱性催化剂,也可作为亲核试剂进行亲核加成反应或 亲核取代反应。 2.与氢卤酸的反应 醇与氢卤酸反应,分子中的碳氧键断裂,羟基被卤素取代生成卤代烃和水。 ROH+HX一→RX+H2O 这是卤代烃水解的逆反应。不同的氢卤酸与相同的醇反应,其活性次序为:HⅡ>HB> HC1。不同的醇与相同的氢卤酸反应,其活性次序为:烯丙型醇>叔醇>仲醇>伯醇。 实验室常用卢卡斯(HJ.Lucas)试剂(浓盐酸与无水氯化锌配成的溶液)来鉴别六个碳 原子以下的一元醇的结构。 山于六个碳原子以下的一元醇可溶于卢卡斯试剂,生成的卤代烃不溶而出现浑浊或分层 现象,根据出现浑浊或分层现象的快慢便可鉴别出该醇的结构。烯丙型醇或叔醇立即出现浑 浊,仲醇要数分钟后才出现浑浊,而伯醇须加热小出现浑浊。六个碳以上的一元醇山于不溶 于卢卡斯试剂,因此无法进行鉴别。 个, 无水ZnC2 个, R一R-OH+HC(浓) >R-C-CI+H2O 立即出现汗浊 Ru 20℃ R R一CHOH+HCI(浓) 无水ZnC2 >R-CH-CI+H2O 数分钟后出现深浊 R 20℃ R 无水ZnC2 RCH2OH+HCI(浓) >RCH2CI H2O 室温下不汗浊 △