
第十一章 杂环化合物和生物碱 教学目标: 1.讲授杂环的结构特点(芳香性及环上缺电子或多π电子的情况)。着重介绍含氮杂环 化合物。应该使学生掌屋几种重要的常见杂环化合物的分子结构与性质。要介绍嘧啶、嘌岭的 羟基与氨基一物的互变异构现象。 2.关于杂环的命名应该以音译名称为主。要求学生记住一些重要杂环的名称与结构式。 生物碱的内容可让学生自学。 教学重点、难点: 杂环的结构、命名。 教学方法、手段:讲授、CAI课件辅助教学。 本章学时:3学时

教学内容: 第十一章杂环化合物和生物碱 杂环化合物和生物碱广泛存在于自然界中,在动植物体内起着重要的生理作用。本章介 绍杂环化合物的分类、命名、结构特点、性质及重要的杂环化合物,生物碱的一般性质、提 取方法和重要的生物碱。 第一节杂环化合物 环状有机化合物中,构成环的原子除碳原子外还含有其它原子,月这种环具有芳香结构, 则这种环状化合物叫做杂环化合物。组成杂环的原子,除碳以外的都叫做杂原子。常见的杂 原子有氧、硫、氮等。前面学习过的环醚、内酯、内酐和内酰胺等都含有杂原子,但它们容 易开环,性质上又与开链化合物相似,所以不把它们放在杂环化合物中讨论。 杂环化合物种类繁多,在自然界中分布很广。具有生物活性的天然杂环化合物对生物体 的生长、发育、遗传和衰亡过程都起着关键性的作用。例:在动、植物体内起着重要生理 作用的血红素、叶绿素、核酸的碱基、中草药的有效成分一生物碱等都是含氮杂环化合物。 一部分维生素、抗菌素、植物色素、许多人工合成的药物及合成染料也含有杂环。 杂环化合物的应用范围极其广泛,涉及医药、农药、染料、生物膜材料、超导材料、分子器 件、贮能材料等,尤共在生物界,杂环化合物几乎随处可见。 一、杂环化合物的分类和命名 为了研究方便,根据杂不母体中所含环的数目,将杂环化合物分为单杂环和稠杂环两大 类。最常见的单杂环有五元环和六元环。稠杂环有芳环并杂环和杂环并杂环两种。另外, 可根据单杂环中杂原子的数目不同分为含一个杂原子的单杂环、含两个杂原子的单杂环等。 杂环化合物的命名在我国有两种方法:一种是译音命名法:另一种是系统命名法。 译音法是根据IUPAC推荐的通用名,按外义名称的译音来命名,并用带“口”芳的同 音汉宁来表示环状化合物。例如: 呋喇 咪唑 吡啶 furan imidazole pyridine purine 杂环上有取代基时,以杂环为母体,将环编号以注明取代基的位次,编号一般从杂原子 开始。含有两个或两个以上相同杂原子的单杂环编号时,把连有氢原子的杂原子编为1,并 使其余杂原子的位次尽可能小:1果环上有多个不同杂原子时,按氧、硫、氮的顺序编号。 例: H30 2,5-甲基呋响 4一甲基咪唑 4,5-甲基噻唑 当只有1个杂原子时,也可用希腊字母编号,靠近杂原子的第一个位置是ū-位,其次 为B-位、y-位等。例如:
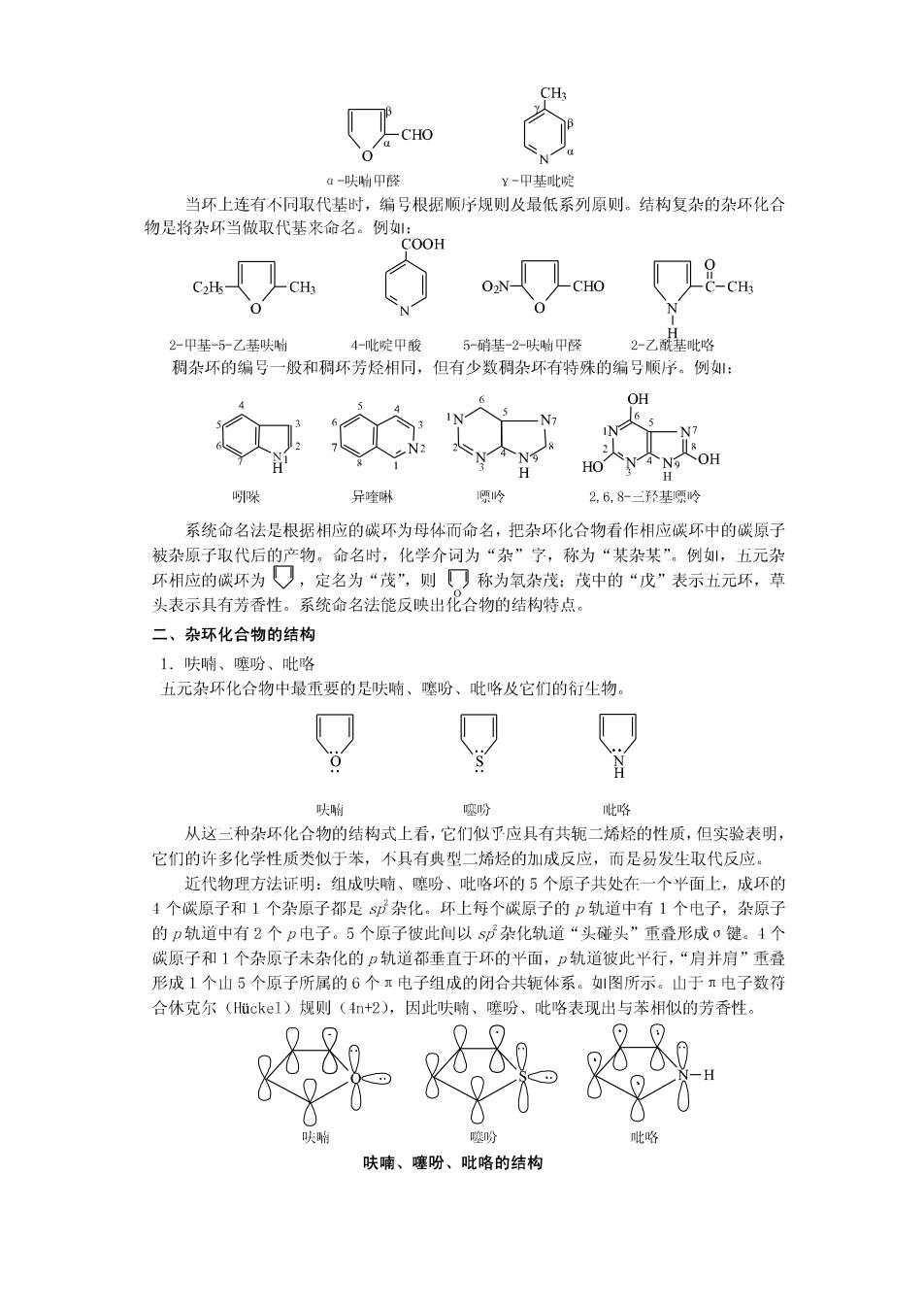
CHO 0 4-呋响甲醛 ¥-甲基吡啶 当环上连有不同取代基时,编号根据顺序规则及最低系列原则。结构复杂的杂环化合 物是将杂环当做取代基来命名。例: COOH CH CHO CH3 2-甲基-5乙基呋时 4-此啶甲酸 5-硝基-2-呋附甲醛 2-乙酰基吡略 稠杂环的编号一般和稠环芳烃相同,但有少数稠杂环有特殊的编号顺序。例: OH N 8 HoN④N9 哚 异喹啉 项岭 2,6,8-三羟基项1岭 系统命名法是根据相应的碳环为母体而命名,把杂环化合物看作相应碳环中的碳原子 被杂原子取代后的产物。命名时,化学介词为“杂”字,称为“某杂某”。例,五元杂 环相应的碳环为,定名为“茂”,则☐称为氧杂茂:茂中的“戊”表示五元环,草 头表示具有芳香性。系统命名法能反映出化合物的结构特点。 二、杂环化合物的结构 1.呋喃、噻吩、吡咯 五元杂环化合物中最重要的是呋喃、噻吩、吡咯及它们的衍生物。 呋啊 噻吩 吡咯 从这三种杂环化合物的结构式上看,它们似乎应具有共轭二烯烃的性质,但实验表明, 它们的许多化学性质类似于苯,不具有典型二烯烃的加成反应,而是易发生取代反应。 近代物理方法证明:组成呋喃、噻吩、吡咯环的5个原子共处在一个平面上,成环的 4个碳原子和1个杂原子都是sp杂化。环上每个碳原子的p轨道中有1个电子,杂原子 的p轨道中有2个p电子。5个原子彼此间以sp杂化轨道“头碰头”重叠形成σ键。4个 碳原子和1个杂原子未杂化的p轨道都垂直于环的平面,p轨道彼此平行,“肩并肩”重叠 形成1个山5个原子所属的6个π电子组成的闭合共轭体系。如图所示。山于π电子数符 合休克尔(Huckel)规则(4n+2),因此呋喃、噻吩、 吡咯表现出与苯相似的芳香性。 努 呋喃、噻吩、吡咯的结构

在呋喃、噻吩、吡略分子中,山于杂原子的未共用电子对参与了共轭体系(6个电 子分布在山5个原子组成的分子轨道中),使环上碳原子的电子云密度增加,因此环中碳 原子的电子云密度相对地大于苯中碳原子的电子云密度,所以此类杂环称为富电子芳杂环 或多电子芳杂环。 杂原子氧、硫、氮的电负性比碳原子大,使环上电子云密度分布不象苯环那样均匀, 所以呋喃、噻吩、吡咯分子中各原子间的键长并不完全相等,因此芳香性比苯差。山于杂 原子的电负性强弱顺序是:氧>氨>硫,所以芳香性强弱顺序下:苯>噻吩>吡咯>呋喃。 2.吡啶 六元杂环化合物中最重要的是吡啶。吡啶的分子结构从形式上看与苯【分相似,可以 看作是苯分子中的一个CH基团被N原子取代后的产物。根据杂化轨道理论,吡啶分子中5 个碳原子和1个氮原子都是经过s杂化而成键的,象苯分子一样,分子中所有原子都处 在同一平面上。与吡咯个同的是,氮原子的二个未成对电子,两个处于sp轨道中,与相 邻碳原子形成σ键,另一个处在p轨道中,与5个碳原子的p轨道半行,侧面重叠形成 个闭合的共轭体系。氮原子尚有一对未共用电子对,处在sD杂化轨道中与环共平面。 图所示。吡啶符合休克尔规则,所以吡啶具有芳香性。 吡啶的结构 在吡啶分子中,山于氮原子的电负性比碳大,表现出吸电子诱导效应,使吡啶环上碳 原子的电子云密度相对降低,因此环中碳原子的电子云密度相对地小于苯中碳原子的电子 云密度,所以此类杂环称为缺电子芳杂环或缺π电子芳杂环。 富电子芳杂环与缺电子芳杂环在化学性质上有较明显的差异。 三、杂环化合物的化学性质 呋喃、噻吩、吡咯都是官电子芳杂环,环上电子云密度分布不象苯那样均匀,因此, 它们的芳香性不苯,有时表现出共轭二烯烃的性质。山于杂原子的电负性不同,它们表 现的芳香性程度也不相同。吡啶是缺电子芳杂环,共芳香性也不苯典型。 1.亲电取代反应 富电子芳杂环和缺电子芳杂环均能发尘亲电取代反应。但是,富电子芳杂环的亲电取 代反应主要发生在电子云密度史为集中的α-位上,而且比苯容易:缺电子芳杂环吡啶 的亲电取代反应主要发生在电子云密度相对较高的B一位上,而且比苯困难。吡啶不易发 生亲电取代,而易发生亲核取代,主要进入α-位,其反应与硝基苯类似。 (1)卤代反应呋喃、噻吩、吡咯比苯活泼,一般不需催化剂就可直接卤代。 +Br2 1,4-氧六环 室温 -Br HBr 。-溴代呋帽 +Br HAC多 +HBr a-溴代噻吩
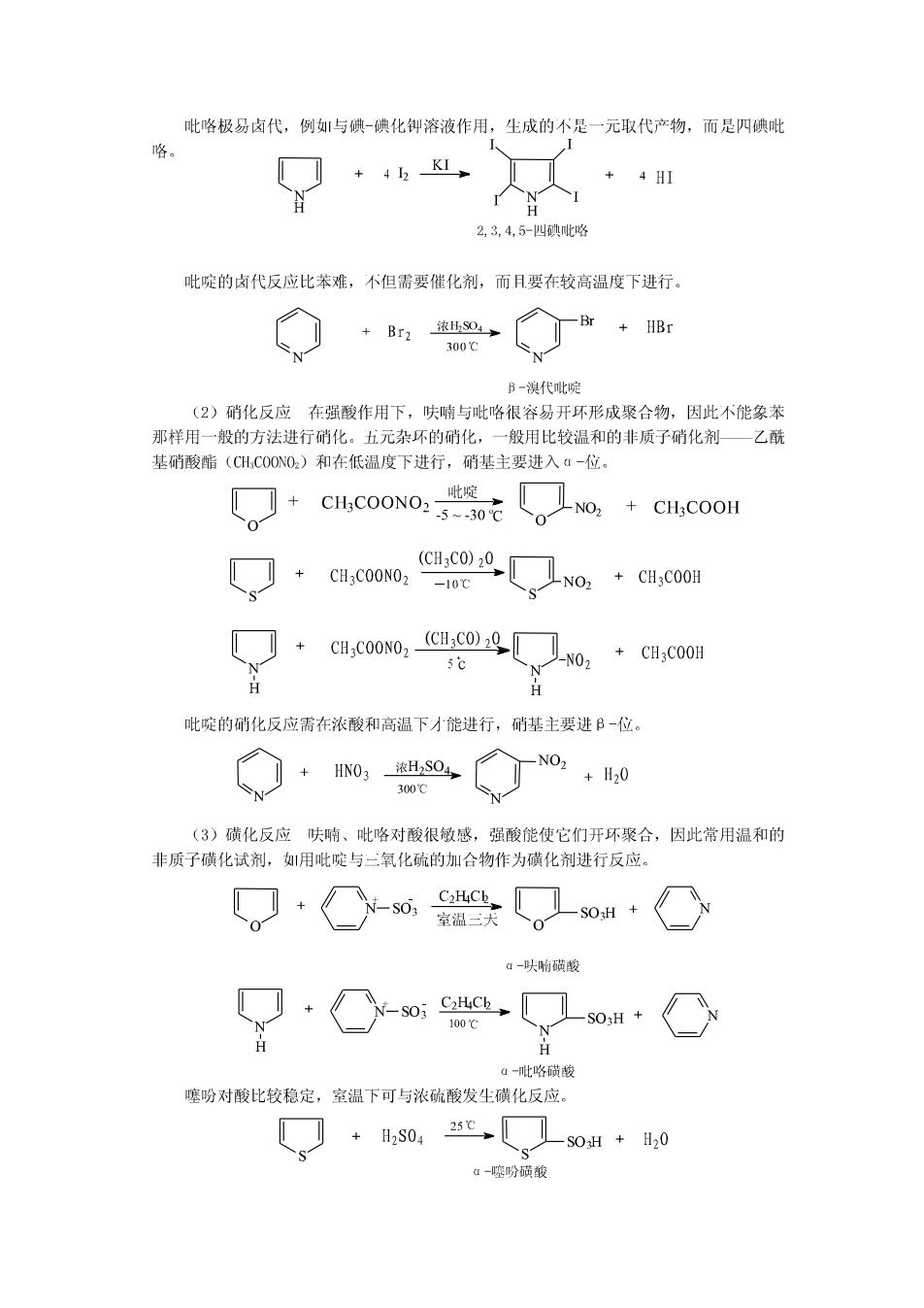
吡咯极易卤代,例与碘-碘化御溶液作用,生成的不是一元取代产物,而是四碘吡 咯 +42K、 + 4HI H 2,3,4,5-四碘吡咯 吡啶的卤代反应比苯难,不但需要催化剂,而.月要在较高温度下进行。 Br Br2 浓HSO4 +HBr 300℃ B-溴代吡啶 (2)硝化反应在强酸作用下,呋喃与吡咯很容易开环形成聚合物,因此不能象苯 那样用一般的方法进行硝化。五元杂环的硝化,一般用比较温和的非质子硝化剂一乙酰 基硝酸脂(CH,COONO2.)和在低温度下进行,硝基主要进入a-位。 CH3COONO2- 啶 5--30℃ no CH:COOH (CH3C0)20 + CH3COONO2 -10℃ CH3COONO2 N0 N 吡啶的硝化反应需在浓酸和高温下才能进行,硝基主要进B-位。 + HN03浓H,SO4, N02 +H20 300℃ (3)磺化反应呋喃、吡咯对酸很敏感,强酸能使它们开环聚合,因此常用温和的 非质子磺化试剂,用吡啶与三氧化硫的加合物作为磺化剂进行反应。 C2HCk_ SO 室温二天 α-呋响磺峻 S03 C2HCh 100℃ H H a-吡咯磺酸 噻吩对酸比较稳定,室温下可与浓硫酸发生磺化反应。 + H2S04 25℃ SOH +H20 a-噻吩磺酸