
第四章 芳香烃 教学目标: 1,苯的分子结构可着重于分子轨道法的处理结果。 2.用电子效应解释苯环上亲电取代反应的定位规律。 3.讲清芳香结构和芳香性的概念。 4.类化合物的讲解应使学生了解类化合物的异戊二烯规律。甾体化合物的讲授应着重 使学生了解环戊烷多氢菲的基本骨架。 教学重点、难点: 苯分子的结构。苯环上的亲电取代反应及其反应历程。亲电取代反应的定位规律及其应用。 教学方法、手段:讲授、CAI课件辅助教学。 本章学时:4学时

教学内容: 第一节 单环芳烃 一、 苯的结构 苯的分子式为CH6,碳氢数目比为1:1,应具有高度个饱和性。事实则不然,在一般条件 下,苯个能被高锰酸御等氧化剂氧化,也个能与卤素、卤化氢等进行加成反应,但它却容易发 生取代发应。并且苯环具有较高的热稳定性,加热到900℃也不分解。象苯环表现出的对热较稳 定,在化学反应中不易发生加成、氧化反应,而易进行取代反应的特性,被称之为芳香性。 苯具有的特殊性质一芳香性,必然是山于它存在一个特殊的结构所决定的。 1865年,凯库勒(Kekule')提出了苯的环状对称结构式: 简写式 此式称为苯的凯库勒式,碳环是山二个C-C和三个C一C交替排列而成。它可以说明苯分 子的组成及原子相互连接次序,并表明碳原子是四价的,六个氢原子的位臀等同,因而可以解 释苯的一元取代产物只有一种的实验事实。但是凯库勒式个能解释苯环在一般条件下不能发生 类似烯烃的加成、氧化反应:也不能解释苯的邻位二元取代产物只有一种的实验事实。按凯库 勒式推测苯的邻位二元取代产物,应有以下两种: 显然,凯库勒式不能表明苯的真实结构。 近代物理方法测定证明,苯分子中的六个碳原子和六个氢原子都在同一平面上,碳-碳键长 均相等(0.1396m),六个碳原子组成一个正六边形,所有键角均为120°。 H 120} 1200 H 1200 0.1396nm H H 苯分子的结构 现代价键理论认为,苯分子中的碳原子均为sp杂化,每个碳原子的三个p杂化轨道分别 与相邻的两个碳原子的sp杂化轨道和氢原子的轨道重叠形成三个σ键。山于三个sp杂化轨 道都处在同一平面内,所以苯分子中的所有碳原子和氢原子必然都在同一平面内,六个碳原子 形成一个正六边形,所有键角均为120°。另外,每个碳原子上还有一个未参州杂化的p轨道, 这些p轨道的对称轴互相平行,月垂直于苯环所在的平面。p轨道之间彼此重叠形成一个闭合共 轭大π键,闭合共轭大π键电子云呈轮胎状,对称分布在苯环平面的上方和下方。因此J.Thiele 建议用 来表示苯的结构

(a) (b) 苯分子中的p轨道及p轨道重叠形成的闭合共轭大π键示意图 山于六个碳原子完全等同,所以大π键电子云在六个碳原子之间均匀分布,即电子云分布 完全平均化,因此碳-碳键长完全相等,不存在单双键之分。山于苯环共轭大π键的高度离域, 使分子能量大大降低,因此苯环具有高度的稳定性。 苯分子的稳定性可用热化学常数一氢化热来证明。例如,环己烯的氢化热为119.5kJ小·mo H2 119.5 kJ.mol-I 果把苯的结构看成是凯库勒式所表示的环己二烯,它的氢化热应是环己烯的二倍,即为 358.5 kJ*mol",而实际测得苯的氢化热仪为208 kJmol,比358.5 kJmol低150.5kJmo。 这充分说明苯分子不是环己二烯的结构,即分子中不存在二个典型的碳-碳双键。我们把苯和环 己三烯氢化热的差值150.5kJ·mo称为苯的离域能或共轭能。正是山于苯具有离域能,使苯比 环己三烯稳定得多。事实上,环己三烯的结构是根本不可能稳定存在的。 分子轨道理论认为,苯分子中碳原子上未参与杂化的六个P轨道线性组合成六个π分子轨 道,分别以Ψ1、Ψ、平、Ψ、Ψs、Ψ:表示。其中Ψ1、Ψ2、Ψ为成键轨道,Ψ、Ψs、Ψ。 为反键轨道。根据电子填充原则,基态时,苯分子中的六个P电子都填充在二个成键轨道上。 三个成键轨道叠加在一起,其形状似两个轮胎对称的分布在苯环平面的两侧。成键分子轨道的 π电子云高度离域,使分子能量最低,因此苯的结构非常稳定。 反键轨道 原子轨道 ↓2 了成键轨道 图3-3苯的Ⅱ分子轨道和能级 二、单环芳烃的异构和命名 苯是最简单的单环芳烃。单环芳烃包括苯、苯的同系物和苯基取代的不饱和烃。 1.一元烷基苯 一元烷基苯中,当烷基碳链含有三个或二个以上碳原子时,山于碳链的不同会产生同分异 构体。烷基苯的命名,一般是以苯作母体,烷基作取代基,称为“某基苯”,基字可省略。例
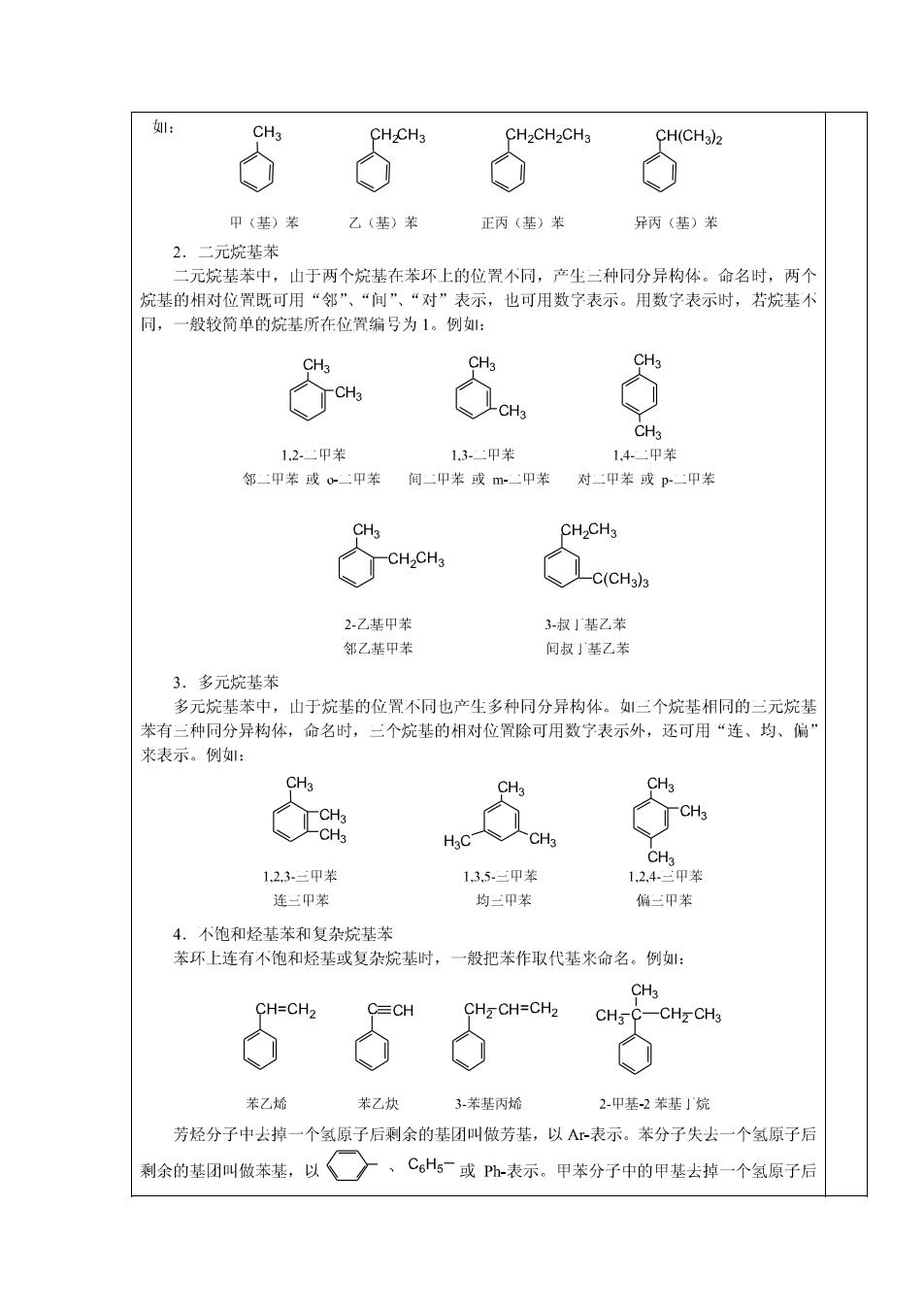
: CH3 CHCH3 CH2CH2CH3 CH(CH3)2 甲(基)苯 乙(基)苯 正丙(基)苯 异丙(基)苯 2.二元烷基苯 二元烷基苯中,山于两个烷基在苯环上的位置不同,产生二种同分异构体。命名时,两个 烷基的相对位置既可用“邻”、“间”、“对”表示,也可用数字表示。用数字表示时,若烷基不 同,一般较简单的烷基所在位置编号为1。例: CH3 CH3 CH3 CH3 CH3 CH3 1.2.甲苯 13-甲苯 1.4-甲苯 邻二甲苯或0二甲苯 间二甲苯或m-二甲苯 对二甲苯或p二甲苯 CH3 CH2CH3 CH2CH3 C(CH3)3 2-乙基甲苯 3-叔」基乙苯 邻乙基甲苯 间叔」基乙苯 3.多元烷基苯 多元烷基苯中,山于烷基的位置不同也产生多种同分异构体。三个烷基相同的三元烷基 苯有二种同分异构体,命名时,二个烷基的相对位置除可用数宁表示外,还可用“连、均、偏” 来表示。例: CH3 CH3 CH3 CH3 -CH3 CH3 CH3 1,23-三甲苯 13,5.甲苯 1.2.4三甲苯 连三甲苯 均三甲苯 偏二甲苯 4.不饱和烃基苯和复杂烷基苯 苯环上连有不饱和烃基或复杂烷基时,一般把苯作取代基来命名。例: CH3 CH=CH2 CHzCH=CH2 CHs C-CHzCH3 苯乙烯 苯乙炔 3苯基丙烯 2甲基-2苯基」烷 芳烃分子中去掉一个氢原子后剩余的基团叫做芳基,以A表示。苯分子失去一个氢原子后 剩余的基团叫做苯基,以 一、C。H或P-表示。甲苯分子中的甲基去掉一个氢原子后

剩余的基团叫卡基或苯甲基,以 CH2或C6H5CH2表示。 三、单环芳烃的物理性质 单环芳烃大多为无色液体,具有特殊气味,相对密度在0.86-0.93之间,不溶于水,易溶于 乙醚、石油醚、乙醇等多种有机溶剂。同时它们本身也是良好的有机溶剂。液体单环芳烃与皮 肤长期接触,会因脱水或脱脂而引起皮炎,使用时要避免与皮肤接触。单环芳烃具有一定的毒 性,长期吸入其蒸气,能损坏造血器官及神经系统,大量使用时应注意防毒。 四、单环芳烃的化学性质 山于苯环上闭合大π键电子云的高度离域,使得苯环非常稳定,在一般条件下大π键难于 断裂进行加成和氧化反应:苯环上大π键电子云分布在苯环平面的两侧,流动性大,易引起亲 电试剂的进攻发尘取代反应。 苯环虫难于被氧化,但苯环上的烃基侧链山于受苯环上大π键的影响,α-氢原子变得很活 泼,易发生氧化反应。同时,α氢原子也易发生卤代反应。 苯环上的闭合共轭大π键虫然很稳定,但它仍然具有一定的不饱和性。因此,在强烈的条 件下,也可发生某些加成反应。 1.取代反应 苯环上的氢原子可以被多种基团取代,其中以卤代、硝化、磺化和傅氏反应较为重要。 (1)卤代反应苯与氯、溴在铁或三卤化铁等催化剂存在下,苯环上的氢原子被氯、溴取 代,生成氯苯和溴苯。 Fe或FeBr3 Br2 55~600C Br HBr 溴苯 卤代仪限于氯代和溴代,卤素的反应活性为:C12>Br2 卤代反应历程大致可分为二步,现以溴代反应为例说明。 ①首先溴分子和三溴化铁作用,生成溴正离子和四溴化铁配离子: Fe Br2 FeBr3 Br-Br FeBr3 Br++FeBr4 ②溴正离子是一个亲电试剂,其进攻富电子的苯环,生成一个不稳定的芳基正离子中间体 (或σ-配合物): 慢 Br ⊙Br 0配合物 这步反应很慢,是决定整个取代反应速度的步骤。在芳基正离子中间体中,原来苯环上的 两个π电子与B生成了C一Br键,余下的四个π电子分布在五个碳原子组成的缺电子共轭体 系中。 ③芳基正离子非常不稳定,在四溴化铁配离子的作用下,迅速脱去一个质子生成溴苯,恢 复到稳定的苯环结构。 Br FeBr3 HBr