
第十四章 氨基酸、蛋白质和核酸 教学目标: 1.氨基酸的两性性质和等电点的概念,蛋白质的沉淀与变性等性质,蛋白质分子的一级与 二级结构。 2.关于多肽的合成,可以简单地说明原理和途径,不必过多介绍。 3.蛋白质的高级结构建议在生化课程中介绍,教师可根据情况自行处理。 4.核酸部分主要讲授核苷酸的组成和DNA的双螺旋结构。 教学重点、难点: 氨基酸的性质。 教学方法、手段:讲授、CAI课件辅助教学。 本章学时:3学时

教学内容 第十三章氨基酸、蛋白质和核酸 蛋白质和核酸是生命现象的物质基础,是参与尘物体内各种生物变化最重要的组分。蛋 白质存在于一切细胞中,它们是构成人体和动植物的基本材料,肌肉、毛发、皮肤、指甲、 血清、血红蛋白、神经、激素、酶等都是山不同蛋白质组成的。蛋白质在有机体中承担不同 的生理功能,它们供给肌体营养、输送氧气、防御疾病、控制代谢过程、传递遗传信息、负 责机械运动等。核酸分子携带着遗传信息,在生物的个体发育、生长、繁殖和遗传变异等尘 命过程中起着极为重要的作用。 人们通过长期的实验发现:蛋白质被酸、碱或蛋白酶催化水解,最终均产尘α-氨基酸。 因此,要了解蛋白质的组成、结构和性质,我们必须先讨论ā-氨基酸。 第一节氨基酸 氨基酸是羧酸分子中烃基上的氢原子被氨基(NH2)取代后的衍生物。目前发现的天 然氨基酸约有300种,构成蛋白质的氨基酸约有30余种,其中常见的有20余种,人们把这 些氨基酸称为蛋白氨基酸。共它不参与蛋白质组成的氨基酸称为非蛋白氨基酸。 一、ā-氨基酸的构型、分类和命名 构成蛋白质的20余种常见氨基酸中除脯氨酸外,都是á-氨基酸,其结构可用通式表示: RCHCOOH NH2 这些α-氨基酸中除甘氨酸外,都含有手性碳原子,有旋光性。其构型一般都是L-型(某 些细菌代谢中产尘极少量D-氨基酸)。 COOH R 1-氨基骏 氨基酸的构型也可用R、S标记法表示。 根据α-氨基酸通式中R-基团的碳架结构不同,a-氨基酸可分为脂肪族氨基酸、芳香族 氨基酸和杂环族氨基酸:根据R-基团的极性不同,α-氨基酸又可分为非极性氨基酸和极性 氨基酸:根据a-氨基酸分子中氨基(NH2)和酸基(-COOH)的数目不同,a-氨基酸还 可分为中性氨基酸(羧基和氨基数目相等)、酸性氨基酸(羧基数目大于氨基数目)、碱性氨 基酸(氨基的数目多于羧基数日)。 氨基酸命名通常根据其来源或性质等采用俗名,例氨基乙酸因具有甜味称为甘氨酸、 丝氨酸最早来源于蚕丝而得名。在使用中为了方便起见,常用英文名称缩写符号(通常为前 三个字母)或用中文代号表示。例如甘氨酸可用Gy或G或“甘”字来表示其名称。氨基 酸的系统命名法与其它取代羧酸的命名相同,即以羧酸为母体命名。 组成蛋白质的氨基酸中,有八种动物自身不能合成,必须从食物中获取,缺乏时会引起 疾病,它们被称为必需氨基酸。 二、ā-氨基酸的物理性质 α-氨基酸一般为无色品体,熔点比相应的羧酸或胺类要高,一般为200一300℃(许多 氨基酸在接近熔点时分解)。除甘氨酸外,其它的ā-氨基酸都有旋光性。大多数氨基酸易溶

于水,而不溶于有机溶剂。 三、ā-氨基酸的化学性质 氨基酸分子中既含有氨基又含有羧基,因此它具有羧酸和胺类化合物的性质:同时,山 于氨基与羧基之间相五影响及分子中R-基团的某些特殊结构,又显示出一些特殊的性质。 1.氨基酸的两性性质和等电点 氨基酸分子中同时含有羧基(-COOH)和氨基(NH2),不仪能与强碱或强酸反应生成 盐,而且还可在分子内形成内盐。 0 RCHCOH ±RCHCO NH2 +NH3 内盐(偶极离子) 氨基酸内盐分子是既带有正电荷又带有负电荷的离子,称为两性离子或偶极离子。固体 氨基酸以偶极离子形式存在,静电引力大,具有很高的熔点,可溶于水而难溶于有机溶剂。 氨基酸分子是偶极离子,在酸性溶液中它的羧基负离子可接受质子,发尘碱式电离带正 电荷:而在碱性溶液中铵根正离子给出质子,发生酸式电离带负电荷。偶极离子加酸和加训碱 时引起的变化,可用下式表示: 0 0 O OH- RCHCOH OH RCHCO RCHCO +NH3 +NH3 H NH2 正离子 偶极离子 负离子 pH<pI pr pH>pI 因此,在不同的pH值中,氨基酸能以正离子、负离子及偶极离子二种不同形式存在。如果 把氨基酸溶液置于电场中,它的正离子会向阴极移动,负离子则会向阳极移动。当调节溶液 的pH值,使氨基酸以偶极离子形式存在时,它在电场中既不向阴极移动,也不向阳极移动, 此时溶液的pH值称为该氨基酸的等电点,通常用符号pI表示。当调节溶液的pH值大于某 氨基酸的等电点时,该氨基酸主要以负离子形式存在,在电场中移向阳极:当调节溶液的 H值小于某氨基酸的等电点时,该氨基酸主要以正离子形式存在,在电场中移向阴极。 应当指出,在等电点时,氨基酸的pH值不等于7。对于中性氨基酸,山于羧基电离度 略大于氨基,因此需要加入适当的酸抑制羧基的电离,促使氨基电离,使氨基酸主要以偶极 离子的形式存在。所以中性氨基酸的等电点都小于7,一般在5-6.3之间。酸性氨基酸的羧 基多于氨基,必须加入较多的酸才能达到其等电点,因此酸性氨基酸的等电点一般在2.8-3.2 之间。要使碱性氨基酸达到其等电点,必须加入适量碱,因此碱性氨基酸的等电点都大于7, 一般在7.6-10.8之间。见表13-2。 氨基酸在等电点时溶解度最小,最容易沉淀,因此可以通过调节溶液pH值达到等电点 来分离氨基酸混合物:也可以利用在同一pH值的溶液中,各种氨基酸所带净电荷不同,它 们在电场中移动的状视不同和对离子交换剂的吸附作用不同的特点,通过电泳法或离子交换 层析法从混合物中分离各种氨基酸。 2.氨基酸中氨基的反应 (1)与亚硝酸反应大多数氨基酸中含有伯氨基,可以定量与亚硝酸反应,生成á羟 基酸,并放氨气。 R-CH-COOH+HNO2一→R-CH-COOH+H20+N2↑ NH2 OH

该反应定量进行,从释放出的氮气的体积可计算分子中氨基的含量。这个方法称为范 斯莱克(Van Slyke)氨基测定法,可用于氨基酸定量和蛋白质水解程度的测定。 (2)与甲醛反应氨基酸分子中的氨基能作为亲核试剂进攻甲醛的羰基,生成(NN 二羟甲基)氨基酸。 R-CH-COOH 2HCHO R-CH-COOH NHz HOH2C-N-CH2OH 在(N,N二羟甲基)氨基酸中,山于羟基的吸电子诱导效应,降低了氨基氮原子的电子云密 度,削弱了氮原子结合质子的能力,使氨基的碱性削弱或消失,这样就可以用标准碱液来滴 定氨基酸的羧基,用于氨基酸含量的测定。这种方法称为氨基酸的甲醛滴定法。 在生物体内,氨基酸分子中的氨基在某些酶的催化下,可与醛酮反应生成弱碱性的西佛碱 (Schiff”base),它是植物体内合成尘物碱及尘物体内酶促转氨基反应的中间产物。 R'CHO+H2NH-COUH一→R'CH=N-CH-0OH 些佛碱 (3)与2,4-二硝基氟苯反应氨基酸能与2,4二硝基氟苯(DNFB)反应尘成N-(2,4- 二硝基苯基)氨基酸,简称N-DNP-氨基酸。这个化合物显黄色,可+用于氨基酸的比色测 定。英国科学家桑格尔(Sanger)首先用这个反应来标记多肽或蛋白质的N-端氨基酸,再 将肽链水解,经层析检测,就可识别多肽或蛋白质的N端氨基酸。 +HN-CHCOOH弱减 NH-CHCOOH HF R R NO2 NO2 N-DNP-氨基酸(黄色) (4)氧化脱氨反应氨基酸分子的氨基可以被双氧水或高锰酸御等氧化剂氧化,生成α -亚氨基酸,然后进一步水解,脱去氨基生成ā-酮酸。 OH 0 [0] H20 R-CH-COOH -R-C-C00H-→R-C-C00H一一R-C-C0OH NH2 NH NH2 4-亚氨基酸a-不基-a-氨基酸 生物体内在悔催化下,氨基酸也可发生氧化脱氨反应,这是生物体内蛋白质分解代谢的重要 反应之一。 3.氨基酸中羧基的反应 (1)与醇反应氨基酸在无水乙醇中通入干燥氯化氢,加热回流时生成氨基酸酯。 0 R-C-C-OnC R-Co- NH2
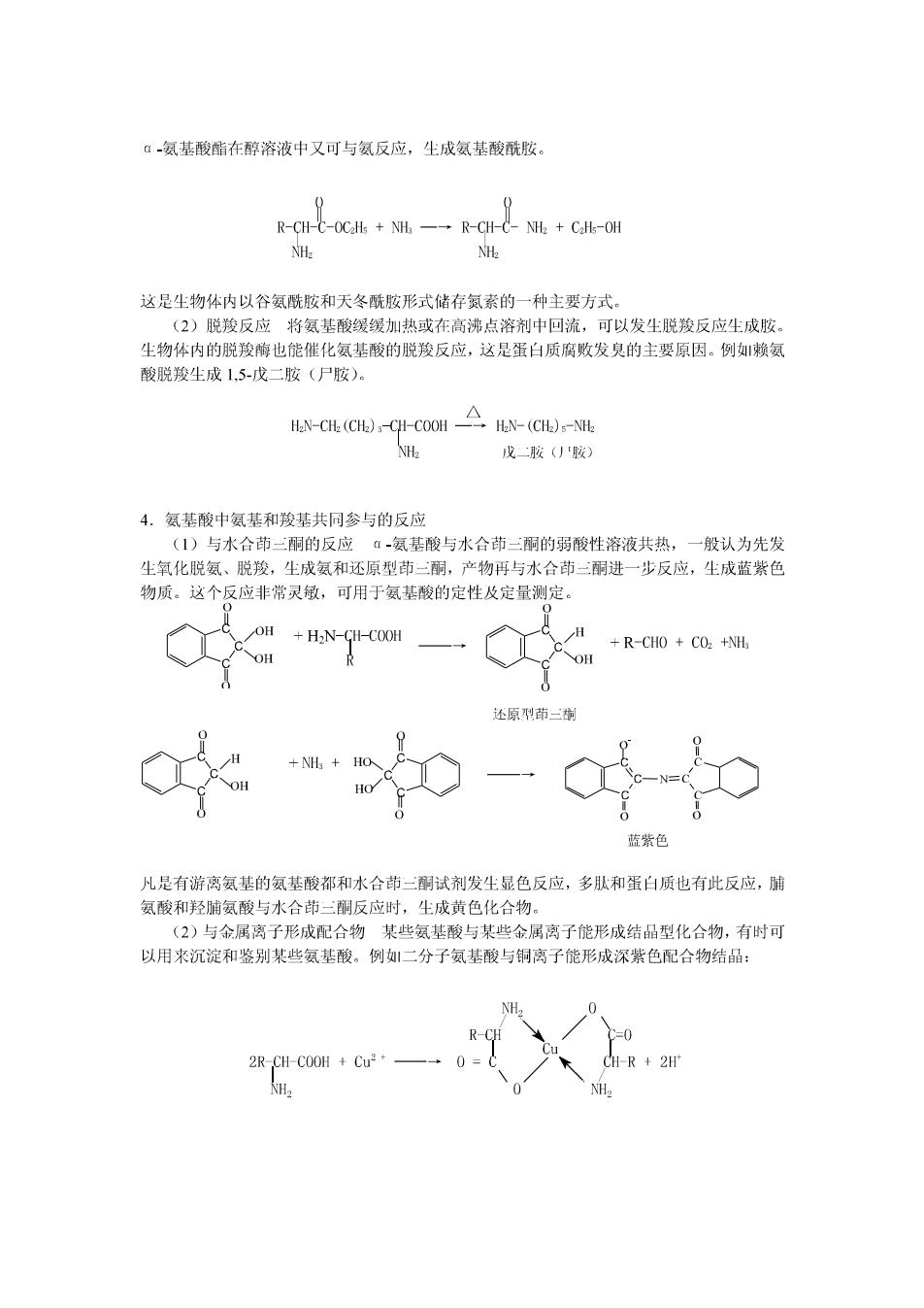
α-氨基酸酯在醇溶液中又可与氨反应,生成氨基酸酰胺。 0 0 R-CH-C-OC2H+NH一→R-CH-CNH2+CH-OH NH2 NH2 这是尘物体内以谷氨酰胺和天冬酰胺形式储存氮素的一种主要方式。 (2)脱羧反应将氨基酸缓缓加热或在高沸点溶剂中回流,可以发生脱羧反应生成胺。 生物体内的脱羧酶也能催化氨基酸的脱羧反应,这是蛋白质腐败发臭的主要原因。例!赖氨 酸脱羧生尘成1,5-戊二胺(尸胺)。 H2N-CH2(CH2)3-CH-COOH →HN-(CH)s-NH NH2 戊二胺('胺) 4.氨基酸中氨基和骏基共同参与的反应 (1)与水合茚二酮的反应α-氨基酸与水合茚三酮的弱酸性溶液共热,一般认为先发 生氧化脱氨、脱羧,生成氨和还原型三酮,产物再与水合茚二酮进一步反应,生成蓝紫色 物质。这个反应非常灵敏,可用于氨基酸的定性及定量测定。 OH +H2N-GH-COOH +R-CHO CO2 +NH 还原刑茚一时 HO 蓝紫色 凡是有游离氨基的氨基酸都和水合茚二酮试剂发生显色反应,多肽和蛋白质也有此反应,脯 氨酸和羟脯氨酸与水合茚三酮反应时,生成黄色化合物。 (2)与金属离子形成配合物某些氨基酸与某些金属离子能形成结品型化合物,有时可 以用来沉淀和鉴别某些氨基酸。例如二分子氨基酸与铜离子能形成深紫色配合物结品: NH 2RCHC00H+Cu2+—→ CH-R 2H NH2