
将结品紫溶于乙醇中,然后与草酸铵溶液混合。 ②革兰氏碘液:碘1.0g,碘化钾20g 荒水300m. 将碘和碘化钾先进行混合,加入蒸馏水少许,充分振荡,待完全溶解后,再加入蒸馆 水至300mL ③沙黄复染液:沙黄0.25g,95%乙醇10mL,燕馏水90mL。将沙黄溶于乙醇中, 然后再用蒸馏水稀释。 (一)大肠菌群MPN计数法(第一法) 大肠菌群MPN计数法的检验程序见图12-1。 1.操作步骤 (1)检样稀释 ①固体和半固体样品:称取25g样品置盛有225mL磷酸盐缓冲液或生理盐水的无菌均 质杯内,8000-10000rmin均质1min-2min.或放入盛有225mL稀释液的无南均质袋 中,用拍击式均质器拍打1mm ②液体样品: 以无菌 菌锥形瓶(瓶内预置适当数量的无南玻璃珠)中,充分混匀,制成1:10的样品匀液。 ③样品匀液的pH应在6.5~7.5之间,必要时分别用1 mol/L NaOH或1 mol/L HC1调 节。 ④用1mL无南吸管或微量移液器吸取1:10样品匀液1mL,沿管壁缓慢注于盛有9mL稀 释液的无茵试管中( 注意吸管或吸头尖端不触及稀释液面) ,振摇试管或换用1支无菌吸 管反复吹打使其混合均匀,制成1:100的样品匀液 ⑤另取1mL无菌吸管或微量移液器,按上条操作方法,做10倍系列稀释液。每递增稀 释一次,换用1次1mL无菌吸管或吸头。 (2)初发酵试验:根据对检样污染状况的估计,洗择3个活官稀释度的样品匀液(液 体样品可以选择原液) 每个稀释度接种3管月桂基硫酸盐胰蛋白胨(LST)肉汤,每管 (如接种量超过1mL,则用双料LST肉汤),36C±1C培养2 h2h,观察倒管内是 否有气泡产生,24h2h产气者进行复发酵试验,如未产气则继续培养至48h+2h,产气者进 行复发酵试验。未产气者为大肠菌群阴性。 (3)复发酵试验:用接种环从产气的ST肉汤管中分别取培养物1环,移种于煌绿乳 糖胆盐肉汤(BGLB)管中,36℃±1℃培养482h,观察产气情况。产气者,计为大肠菌 群阳性管 (4)大肠菌群最可能数(MPN)的报告:按确证的大肠菌群LST阳性管数,检索MPN 表(表1-2-1),报告每g(mL)样品中大肠菌群的MPW值
将结晶紫溶于乙醇中,然后与草酸铵溶液混合。 ② 革兰氏碘液:碘 1.0 g,碘化钾 2.0 g,蒸馏水 300 mL。 将碘和碘化钾先进行混合,加入蒸馏水少许,充分振荡,待完全溶解后,再加入蒸馏 水至 300 mL。 ③ 沙黄复染液:沙黄 0.25 g,95%乙醇 10 mL,蒸馏水 90 mL。将沙黄溶于乙醇中, 然后再用蒸馏水稀释。 (一)大肠菌群MPN计数法(第一法) 大肠菌群MPN计数法的检验程序见图1-2-1。 1. 操作步骤 (1)检样稀释 ① 固体和半固体样品:称取25 g样品置盛有225 mL磷酸盐缓冲液或生理盐水的无菌均 质杯内,8 000~10 000 r/min均质1 min~2 min,或放入盛有225 mL稀释液的无菌均质袋 中,用拍击式均质器拍打1 min~2 min,制成1:10的样品匀液。 ② 液体样品:以无菌吸管吸取25 mL样品置盛有225 mL磷酸盐缓冲液或生理盐水的无 菌锥形瓶(瓶内预置适当数量的无菌玻璃珠)中,充分混匀,制成1:10的样品匀液。 ③ 样品匀液的pH 应在6.5~7.5之间,必要时分别用1 mol/L NaOH 或1 mol/L HCl 调 节。 ④ 用1mL无菌吸管或微量移液器吸取1:10样品匀液1 mL,沿管壁缓慢注于盛有9 mL稀 释液的无菌试管中(注意吸管或吸头尖端不要触及稀释液面),振摇试管或换用1支无菌吸 管反复吹打使其混合均匀,制成1:100的样品匀液。 ⑤ 另取1mL无菌吸管或微量移液器,按上条操作方法,做10倍系列稀释液。每递增稀 释一次,换用1次1 mL 无菌吸管或吸头。 (2)初发酵试验:根据对检样污染状况的估计,选择3个适宜稀释度的样品匀液(液 体样品可以选择原液),每个稀释度接种3管月桂基硫酸盐胰蛋白胨(LST)肉汤,每管接 种1 mL(如接种量超过1 mL,则用双料LST肉汤),36℃±1℃培养24h±2h,观察倒管内是 否有气泡产生,24h±2h产气者进行复发酵试验,如未产气则继续培养至48h±2h,产气者进 行复发酵试验。未产气者为大肠菌群阴性。 (3)复发酵试验:用接种环从产气的LST肉汤管中分别取培养物1环,移种于煌绿乳 糖胆盐肉汤(BGLB)管中,36℃±1℃培养48h±2h,观察产气情况。产气者,计为大肠菌 群阳性管。 (4)大肠菌群最可能数(MPN)的报告:按确证的大肠菌群LST阳性管数,检索MPN 表(表1-2-1),报告每g(mL)样品中大肠菌群的MPN值
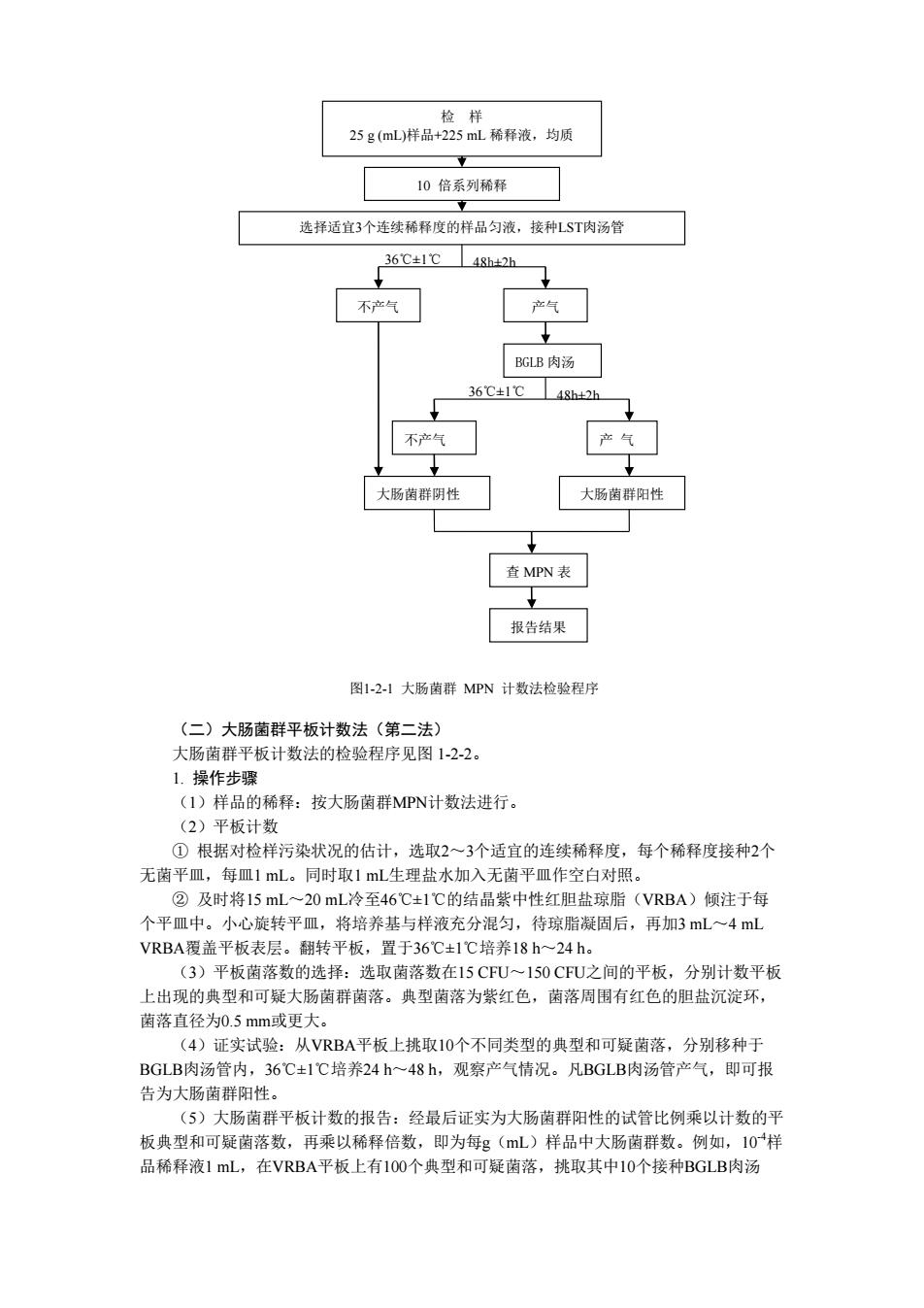
25g(mL样品+225mL稀释液,均质 10倍系列稀释 选择适宜3个连续稀释度的样品匀液,接种LST肉汤管 36C±1℃48d2h 不产气 产气 GLB肉汤 36℃±1℃4gh42 大肠菌群阴性 大肠菌群阳性 查MPN表 报告结果 图1-21大肠菌群MPN计数法检验程序 (二)大肠菌群平板计数法(第二法) 大肠菌群平板计数法的检验程序见图1-2-2。 L.操作步骤 (1)样品的稀释:按大肠菌群MPN计数法进行。 (2)平板计数 ①根据对检样污染状况的估计,选取2一3个适宜的连续稀释度,每个稀释度接种2个 无菌平皿,每皿1ml。同时取1L生理盐水加入无菌平皿作空白对照。 ②及时将15mL~20mL冷至46C±1℃的结晶紫中性红胆盐琼脂(VRBA)倾注于每 个平皿中。小心旋转平皿,将培养基与样液充分混匀,待琼脂凝固后,再加3mL一4mL VRBA覆盖平板表层。翻转平板,置于36C±1C培养18h~24h。 (3)平板菌落数的选择:选取菌落数在15C℉U~150C℉U之间的 ,分别计数平 上出现的典型可聚大肠菌商家·臭面客为紫红色,菌陈周同有红色的测盖沉淀不 菌落直径为0.5mm或更大。 (4)证实试验:从VRBA平板上挑取10个不同类型的典型和可疑菌落,分别移种于 BGLB肉汤管内,36℃±1℃培养24h~48h,观察产气情况。凡BGLB肉汤管产气,即可报 为大肠菌群阳性 (5)大肠菌群平板计数的报告:经最后证实为大肠菌群阳性的试管比例乘以计数的 板典型和可疑菌落数,再乘以稀释倍数,即为每g(mL)样品中大肠菌群数。例如,10样 品稀释液1mL,在VRBA平板上有1O0个典型和可疑菌落,挑取其中10个接种BGLB肉汤
(二)大肠菌群平板计数法(第二法) 大肠菌群平板计数法的检验程序见图 1-2-2。 1. 操作步骤 (1)样品的稀释:按大肠菌群MPN计数法进行。 (2)平板计数 ① 根据对检样污染状况的估计,选取2~3个适宜的连续稀释度,每个稀释度接种2个 无菌平皿,每皿1 mL。同时取1 mL生理盐水加入无菌平皿作空白对照。 ② 及时将15 mL~20 mL冷至46℃±1℃的结晶紫中性红胆盐琼脂(VRBA)倾注于每 个平皿中。小心旋转平皿,将培养基与样液充分混匀,待琼脂凝固后,再加3 mL~4 mL VRBA覆盖平板表层。翻转平板,置于36℃±1℃培养18 h~24 h。 (3)平板菌落数的选择:选取菌落数在15 CFU~150 CFU之间的平板,分别计数平板 上出现的典型和可疑大肠菌群菌落。典型菌落为紫红色,菌落周围有红色的胆盐沉淀环, 菌落直径为0.5 mm或更大。 (4)证实试验:从VRBA平板上挑取10个不同类型的典型和可疑菌落,分别移种于 BGLB肉汤管内,36℃±1℃培养24 h~48 h,观察产气情况。凡BGLB肉汤管产气,即可报 告为大肠菌群阳性。 (5)大肠菌群平板计数的报告:经最后证实为大肠菌群阳性的试管比例乘以计数的平 板典型和可疑菌落数,再乘以稀释倍数,即为每g(mL)样品中大肠菌群数。例如,10-4样 品稀释液1 mL,在VRBA平板上有100个典型和可疑菌落,挑取其中10个接种BGLB肉汤 检 样 25 g (mL)样品+225 mL 稀释液,均质 10 倍系列稀释 选择适宜3个连续稀释度的样品匀液,接种LST肉汤管 36℃±1℃ 产气 BGLB 肉汤 不产气 产 气 48h±2h 不产气 大肠菌群阴性 大肠菌群阳性 查 MPN 表 报告结果 36℃±1℃ 48h±2h 图1-2-1 大肠菌群 MPN 计数法检验程序

管,证实有6个阳性管,则该样品的大肠菌群数为:100×6/10x10g(mL)=6.0×10CFUg (mL) 10倍系列稀释 选择2一3个适宜稀释度的样品匀液,接种VRBA平板 36℃1℃18h~24h 计数典型和可疑菌落 BGLB肉汤 36c+124h-48 报告结果 图12-2大肠菌群平板计数法检验程序 表1-21大肠菌群最可能数(MPN)检索表 阳性管 95%可信限 0.10 0.001 MPN 0.01 下限 上限 0 0 0 9.5 0 0 0 015 3 0 0 18 0 0 1 0 88 1 0 0 7.4 613 2 1 11 ( 562 2 66515455 2 2 2 405022 8222582222424 22 35 87
管,证实有6个阳性管,则该样品的大肠菌群数为:100×6/10×104 /g(mL)=6.0×105CFU/g (mL)。 、 表 1-2-1 大肠菌群最可能数(MPN)检索表 阳性管数 MPN 95%可信限 0.10 0.01 0.001 下限 上限 0 0 0 <3.0 — 9.5 0 0 1 3.0 0.15 9.6 0 1 0 3.0 0.15 11 0 1 1 6.1 1.2 18 0 2 0 6.2 1.2 18 0 3 0 9.4 3.6 38 1 0 0 3.6 0.17 18 1 0 1 7.2 1.3 18 1 0 2 11 3.6 38 1 1 0 7.4 1.3 20 1 1 1 11 3.6 38 1 2 0 11 3.6 42 1 2 1 15 4.5 42 1 3 0 16 4.5 42 2 0 0 9.2 1.4 38 2 0 1 14 3.6 42 2 0 2 20 4.5 42 2 1 0 15 3.7 42 2 1 1 20 4.5 42 2 1 2 27 8.7 94 2 2 0 21 4.5 42 2 2 1 28 8.7 94 2 2 2 35 8.7 94 检 样 25 g(mL)样品+225mL 稀释液,均质 10 倍系列稀释 选择 2~3个适宜稀释度的样品匀液,接种VRBA平板 36℃±1℃ 计数典型和可疑菌落 BGLB 肉汤 报告结果 18h~24h 36℃±1℃ 24h~48h 图 1-2-2 大肠菌群平板计数法检验程序

3 0 29 8.7 3 36 8 、2 0 46 3 3 64 17 3 0 9 120 3 3 160 0 9 18 420 150 37 420 210 40 430 290 1.00 3 0 240 42 1.0m 3 3 46n 3.000 3 1100 180 4,100 >1100 420 注:①本表采用3个稀释度0.1g(mL)、0.01g(mL)和0.001gmlL小,每个稀释度接种3管.②表内 所列检样量如政用g(mL)、0.1g(mL)和0.01g(mL)时。 表内数 应相应降低10倍:如改用001g(mL) 0.001g(ml、0.0001g(mL)时,则表内数字应相应增高10倍,其余类推。 三、动物性食品中沙门氏菌的检验 沙门氏菌属(Salmor ell@)是肠杆菌科的一个大属,也是肠杆菌科中最重要的病原菌属,沙 门氏菌屈(Salmonella)为肠杆菌科中的一个大属,仅包括2个种,即肠道沙门氏南(S.enterica) 和博恩格律沙门氏菌(S.bongori)。引起人和食品动物发生感染最常见的属于肠道亚种。沙 门氏菌约有2000多个血清型和变种,我国已发现120多个血清型。本属细菌绝大多数成员 对人和动物有致病性,能引起人和动物的败血症与目肠炎,其至流产,并能引起人类食物中 毒,是人类细菌性食物中毒的最主要病原茵之 世界各地的食物中毒病例中,英国、中国 沙门氏菌食物中毒居首位,美国沙门氏菌食物中毒居第二位。沙门氏菌常作为食品致病菌指 标。食品中沙门氏菌检验按GB4789.4一2010《食品安全国家标淮食品微生物学检验沙门 氏菌检验》进行。 1设备和材料除微生物实验室常规灭菌及培养设各外,其他设备和材料如下: (2)恒温培养箱:36C±1C,42℃±1℃ (3)均质器。 (4)振荡器。 (5)电子天平:感量01g (6)无菌锥形瓶:容量500mL,250mL (7)无菌吸管:1mL(具0.01mL刻度)、10mL(具0.1mL刻度)或微量移液器及 吸头 (8)无菌培养皿:直径90mm。 (9)无菌试管:3mm×50mm、10mm×75mm。 (10)无南毛细管。 (II)pH计或pH比色管或精密pH试纸。 (12)全自动微生物生化鉴定系统
2 3 0 29 8.7 94 2 3 1 36 8.7 94 3 0 0 23 4.6 94 3 0 1 38 8.7 110 3 0 2 64 17 180 3 1 0 43 9 180 3 1 1 75 17 200 3 1 2 120 37 420 3 1 3 160 40 420 3 2 0 93 18 420 3 2 1 150 37 420 3 2 2 210 40 430 3 2 3 290 90 1,000 3 3 0 240 42 1,000 3 3 1 460 90 2,000 3 3 2 1100 180 4,100 3 3 3 >1100 420 -- 注:①本表采用3个稀释度[0.1g (mL)、0.01 g (mL)和 0.001 g (mL)],每个稀释度接种 3 管。②表内 所列检样量如改用lg(mL)、0.1 g (mL)和0.01g (mL)时,表内数字应相应降低10倍;如改用 0.01g (mL)、 0.001g (mL)、0.0001g (mL)时,则表内数字应相应增高10倍,其余类推。 三、动物性食品中沙门氏菌的检验 沙门氏菌属(Salmonella)是肠杆菌科的一个大属,也是肠杆菌科中最重要的病原菌属,沙 门氏菌属(Salmonella)为肠杆菌科中的一个大属,仅包括 2 个种,即肠道沙门氏菌(S.enterica) 和博恩格律沙门氏菌(S.bongori)。引起人和食品动物发生感染最常见的属于肠道亚种。沙 门氏菌约有 2 000 多个血清型和变种,我国已发现 120 多个血清型。本属细菌绝大多数成员 对人和动物有致病性,能引起人和动物的败血症与胃肠炎,甚至流产,并能引起人类食物中 毒,是人类细菌性食物中毒的最主要病原菌之一。世界各地的食物中毒病例中,英国、中国 沙门氏菌食物中毒居首位,美国沙门氏菌食物中毒居第二位。沙门氏菌常作为食品致病菌指 标。食品中沙门氏菌检验按 GB 4789.4—2010《食品安全国家标准 食品微生物学检验 沙门 氏菌检验》进行。 1. 设备和材料 除微生物实验室常规灭菌及培养设备外,其他设备和材料如下: (1)冰箱:2℃~4℃。 (2)恒温培养箱:36℃±1℃,42℃±1℃。 (3)均质器。 (4)振荡器。 (5)电子天平:感量0.1 g。 (6)无菌锥形瓶:容量500 mL,250 mL。 (7)无菌吸管:1 mL(具0.01 mL刻度)、10 mL(具0.1 mL刻度)或微量移液器及 吸头。 (8)无菌培养皿:直径90 mm。 (9)无菌试管:3 mm×50 mm、10 mm×75 mm。 (10)无菌毛细管。 (11)pH计或pH比色管或精密pH 试纸。 (12)全自动微生物生化鉴定系统