
扩散系数 D = RT/N6πrη (m2 /s) R 气体常数 N 阿伏加德罗常数 T 绝对温度 η 介质粘度 r 球形分子的直径
扩散系数 D = RT/N6πrη (m2 /s) R 气体常数 N 阿伏加德罗常数 T 绝对温度 η 介质粘度 r 球形分子的直径

2 影响扩散速度的因素 dc/dt ↑ dQ/dt ↑ A ↑ dQ/dt ↑ 扩散系数 D ↑ dQ/dt ↑ r ↑ D ↓ T ↑ D↑ η ↑ D ↓
2 影响扩散速度的因素 dc/dt ↑ dQ/dt ↑ A ↑ dQ/dt ↑ 扩散系数 D ↑ dQ/dt ↑ r ↑ D ↓ T ↑ D↑ η ↑ D ↓
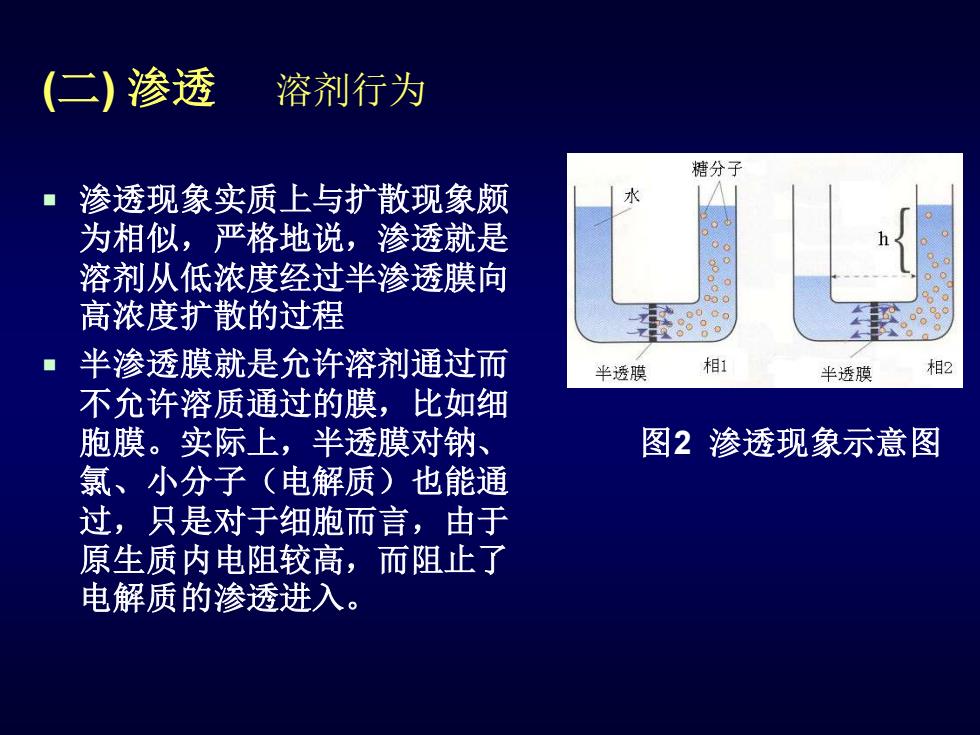
(二) 渗透 溶剂行为 渗透现象实质上与扩散现象颇 为相似,严格地说,渗透就是 溶剂从低浓度经过半渗透膜向 高浓度扩散的过程 半渗透膜就是允许溶剂通过而 不允许溶质通过的膜,比如细 胞膜。实际上,半透膜对钠、 氯、小分子(电解质)也能通 过,只是对于细胞而言,由于 原生质内电阻较高,而阻止了 电解质的渗透进入。 图2 渗透现象示意图
(二) 渗透 溶剂行为 渗透现象实质上与扩散现象颇 为相似,严格地说,渗透就是 溶剂从低浓度经过半渗透膜向 高浓度扩散的过程 半渗透膜就是允许溶剂通过而 不允许溶质通过的膜,比如细 胞膜。实际上,半透膜对钠、 氯、小分子(电解质)也能通 过,只是对于细胞而言,由于 原生质内电阻较高,而阻止了 电解质的渗透进入。 图2 渗透现象示意图

1 Van’t hoff方程 溶液的渗透压和理想气体的性质是完全相似的,可 用Van’t hoff 方程式表示:P284 PV=nRT= RTG/M G 1 G P0 = —— · —— · RT =Cm ·RT (Cm = ——) M V MV P0 — 渗透压(N/m2) Cm—溶液的摩尔浓度 mol/L V — 溶液的容积(L或m3) T— 绝对温度(K) G — 溶质质量 (kg) R- 气体常数 8.29×10-3N·m/mol·K M— 溶质分子量
1 Van’t hoff方程 溶液的渗透压和理想气体的性质是完全相似的,可 用Van’t hoff 方程式表示:P284 PV=nRT= RTG/M G 1 G P0 = —— · —— · RT =Cm ·RT (Cm = ——) M V MV P0 — 渗透压(N/m2) Cm—溶液的摩尔浓度 mol/L V — 溶液的容积(L或m3) T— 绝对温度(K) G — 溶质质量 (kg) R- 气体常数 8.29×10-3N·m/mol·K M— 溶质分子量

若溶质有解离时,它对渗透压的贡献就要增加 P0 = iCRT i —— 等渗系数(物质解离因素) 当完全解离上时,i= 2 如NaCl
若溶质有解离时,它对渗透压的贡献就要增加 P0 = iCRT i —— 等渗系数(物质解离因素) 当完全解离上时,i= 2 如NaCl