
第三节蛋白质的三维结构 三维结构示意图 一、研究蛋白质构象的方法 二、稳定蛋白质三维结构的作用力 三、蛋白质的二、三、四级结构 四、蛋白质折叠和结构预测 ■本节小结
9/29/2024 2 第三节 蛋白质的三维结构 三维结构示意图 一、研究蛋白质构象的方法 二、稳定蛋白质三维结构的作用力 三、蛋白质的二、三、四级结构 四、蛋白质折叠和结构预测 本节小结
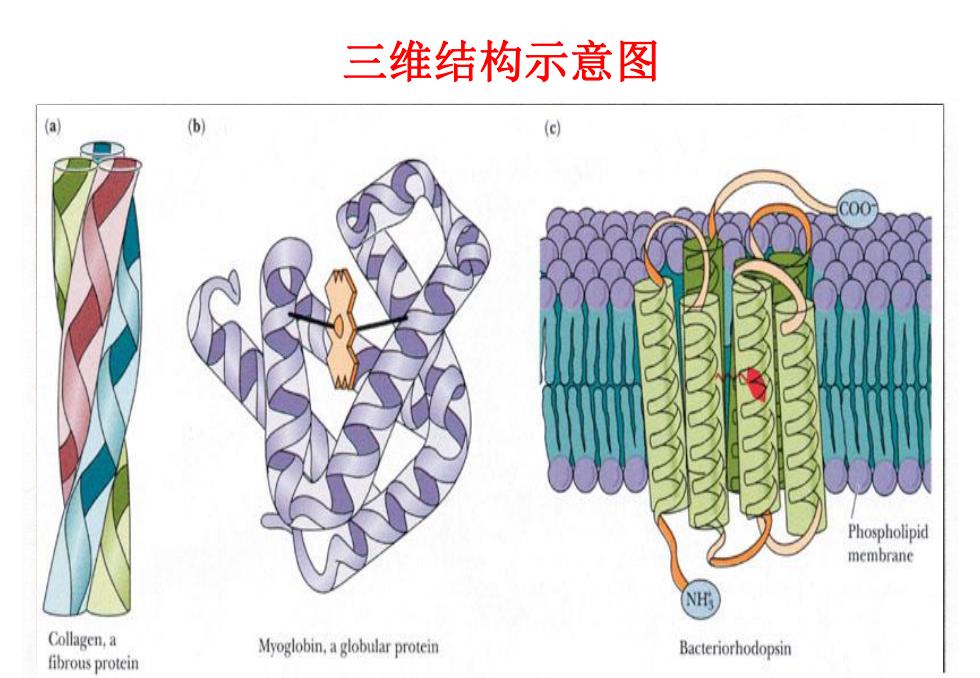
三维结构示意图 a (e) 00 Phospholipid membrane NH Collagen,a Myoglobin,a globular protein Bacteriorhodopsin fibrous protein
9/29/2024 3 三维结构示意图
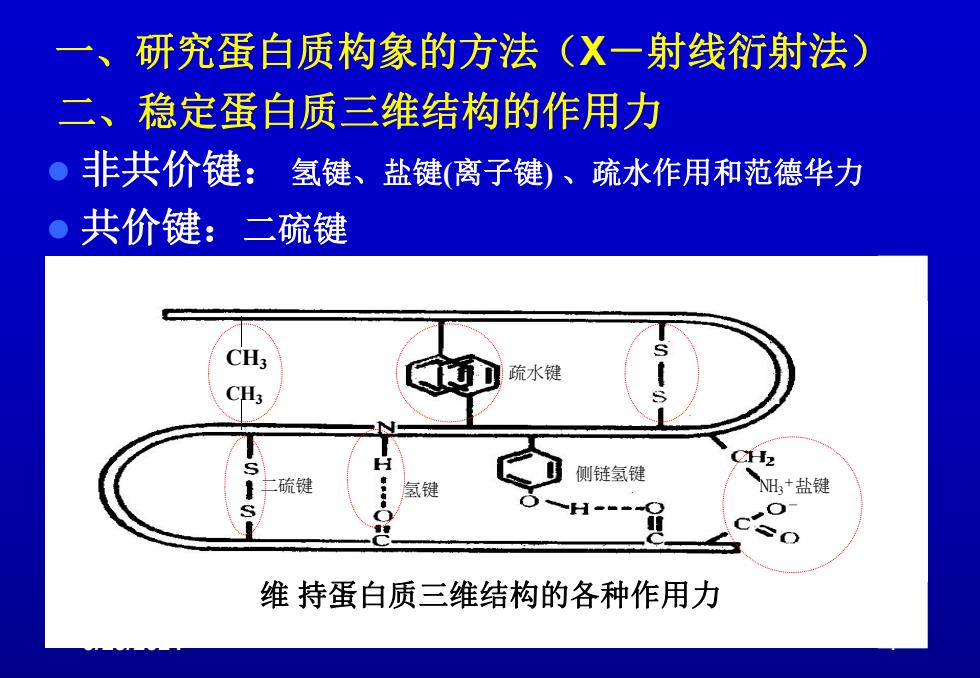
一、研究蛋白质构象的方法(X一射线衍射法) 二、稳定蛋白质三维结构的作用力 非共价键:氢键、盐键(离子键)、疏水作用和范德华力 共价键:二硫键 疏水键 侧链氢键 硫键 氢键 NH,+盐键 维持蛋白质三维结构的各种作用力
9/29/2024 4 一、研究蛋白质构象的方法(X-射线衍射法) 二、稳定蛋白质三维结构的作用力 l 非共价键: 氢键、盐键(离子键) 、疏水作用和范德华力 l 共价键:二硫键 图4-6 维持蛋白质空间结构的化学键 二硫键 氢键 侧链氢键 疏水键 NH3+盐键 CH3 CH3 维 持蛋白质三维结构的各种作用力

三、蛋白质的二、三、四级结构 (一)二级结构与纤维状蛋白质 二级结构:蛋白质主链的折叠产生由氢键维系 的有规则的构象。 主要有o-螺旋、B-折叠、B-转角。 这些结构可在一条多肽链的不同区段形成。 是由R基的短程顺序决定。 9129/2024 5
9/29/2024 5 三、蛋白质的二、三、四级结构 (一) 二级结构与纤维状蛋白质 v二级结构:蛋白质主链的折叠产生由氢键维系 的有规则的构象。 v主要有-螺旋、-折叠、-转角。 v这些结构可在一条多肽链的不同区段形成。 v是由R基的短程顺序决定
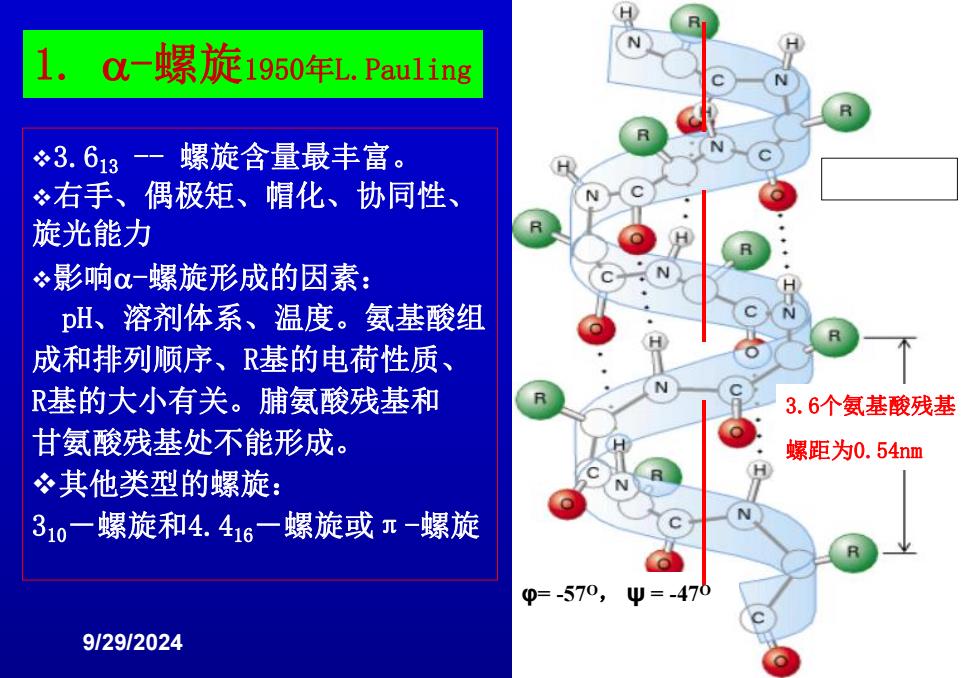
C一螺旋1950年L.Pau1ling 3.613 -一螺旋含量最丰富。 右手、偶极矩、帽化、协同性、 旋光能力 影响α螺旋形成的因素: pH、溶剂体系、温度。氨基酸组 成和排列顺序、R基的电荷性质、 R基的大小有关。脯氨酸残基和 R 3.6个氨基酸残基 甘氨酸残基处不能形成。 螺距为0.54nm 其他类型的螺旋: 310一螺旋和4.416一螺旋或π一螺旋 N 0=-570, =-4 9129/2024
9/29/2024 6 v3.613 - 螺旋含量最丰富。 v右手、偶极矩、帽化、协同性、 旋光能力 v影响-螺旋形成的因素: pH、溶剂体系、温度。氨基酸组 成和排列顺序、R基的电荷性质、 R基的大小有关。脯氨酸残基和 甘氨酸残基处不能形成。 v其他类型的螺旋: 310-螺旋和4.416-螺旋或π-螺旋 φ= -57O, ψ = -47O 3.6个氨基酸残基 螺距为0.54nm 1. -螺旋1950年L.Pauling