
《无机化学》教学大纲 说明 一、适用范围 大学本科化学、应用化学专业 二、课程性质、地位及作用 无机化学是高等院校化学专业学生第一门必修的化学基础课。它既与中学化学内容相衔接,又 要为后继课程(分析化学、有机化学、物理化学、结构化学等)的学习打下基础,对学生学习起承 前启后的作用。考虑到当前化学的迅猛发展和近几年化学化工学院新生的特点,大纲强调在无机化 学教学中既要重视基础课内容的阐述,又要适当介绍现代化学中的新的发展,以期学生通过化学的 学习,不但掌握无机化学的基本内容,又适当了解现代化学的发展特点,充分地发挥学生学习化学 的能动性,提高学生学习化学的兴趣。 三、本课程的教学目的和要求 本课程的主要任务是使学生享握元素周期律、物质结构理论基本知识、 化学热力学、化学反应速 化坏原 在上述理 重要完素及其化合物的主要性质、结构 左在 、制法、用 基本知识。 高时适介绍现代化学的 终然作盒经件客要学花精莫高注空林理含 培养学生独立进行化学计算和利用参考资料自学等方面的能力。强化 四、教学方法提示 本课程课堂讲授总学时数为126,分两学期进行。理论部分的深度和广度应以能够阐明无机化学 的基本知识为准则,并充分考虑到学生的接受能力。叙述部分以重要元素及其化合物的特性和典型 反应为最基本知识,充分重视典型的具有实际意义的元素及其化合物的学习。注重培养学生科学的 思维方法,提高学生运用基础理论解决问题、分析问题的能力。 五、教学方式 因课堂讲授时数有限,而有些理论和概念较为抽象,元素及其化合物知识又相当繁琐,过去讲 授时大量进行的课堂演示不宜再大量使用。本课程充分采用现代化的教学手段,运用多媒体课件和 黑板板书相结合,教师讲授和课堂提问、讨论相结合,充分调动学生的学习积极性,由浅入深、循 序渐进地进行基础理论、元素及其化合物知识的教学。讲课形式生动活泼,既保证所学知识体系的 完整性和较大信息量的输入,又易激发学生学习兴趣,能保证良好的教学效果。 为了逐渐推进双语教学,本课程选定的电子课件适当配备了部分英文内容,教学采用汉语 (主)和英语(辅);为保证双语教学的教学质量,主讲教师需要进行英语专门培训。 六、考试方法 闭卷笙试 七、使用教材 《无机化学》(上,下册),武汉大学、吉林大学等校编,高等教育出版社,第三版,1994年4月出版 八、教学时数分配 编 目 内容 讲授学时 第一章 绪论 2学时 第二章 物质的状态 4学时
《无机化学》教学大纲 说 明 一、适用范围 大学本科化学、应用化学专业 二、课程性质、地位及作用 无机化学是高等院校化学专业学生第一门必修的化学基础课。它既与中学化学内容相衔接,又 要为后继课程(分析化学、有机化学、物理化学、结构化学等)的学习打下基础,对学生学习起承 前启后的作用。考虑到当前化学的迅猛发展和近几年化学化工学院新生的特点,大纲强调在无机化 学教学中既要重视基础课内容的阐述,又要适当介绍现代化学中的新的发展,以期学生通过化学的 学习,不但掌握无机化学的基本内容,又适当了解现代化学的发展特点,充分地发挥学生学习化学 的能动性,提高学生学习化学的兴趣。 三、 本课程的教学目的和要求 本课程的主要任务是使学生掌握元素周期律、物质结构理论基本知识、化学热力学、化学反应速 率、化学平衡、氧化还原、配合离解和沉淀溶解等基本理论。并在上述理论的指导下,理解和掌握 重要元素及其化合物的主要性质、结构、存在、制法、用途等基本知识。同时适当介绍现代化学的 新发展、特点及研究新方法。培养学生独立进行化学计算和利用参考资料自学等方面的能力。强化 学生的专业思想,激发学生学习化学的兴趣,全面提高学生的综合素质。 四、教学方法提示 本课程课堂讲授总学时数为126,分两学期进行。理论部分的深度和广度应以能够阐明无机化学 的基本知识为准则,并充分考虑到学生的接受能力。叙述部分以重要元素及其化合物的特性和典型 反应为最基本知识,充分重视典型的具有实际意义的元素及其化合物的学习。注重培养学生科学的 思维方法,提高学生运用基础理论解决问题、分析问题的能力。 五、教学方式 因课堂讲授时数有限,而有些理论和概念较为抽象,元素及其化合物知识又相当繁琐,过去讲 授时大量进行的课堂演示不宜再大量使用。本课程充分采用现代化的教学手段,运用多媒体课件和 黑板板书相结合,教师讲授和课堂提问、讨论相结合,充分调动学生的学习积极性,由浅入深、循 序渐进地进行基础理论、元素及其化合物知识的教学。讲课形式生动活泼,既保证所学知识体系的 完整性和较大信息量的输入,又易激发学生学习兴趣,能保证良好的教学效果。 为了逐渐推进双语教学,本课程选定的电子课件适当配备了部分英文内容,教学采用汉语 (主)和英语(辅);为保证双语教学的教学质量,主讲教师需要进行英语专门培训。 六、考试方法 闭卷笔试 七、使用教材 《无机化学》(上,下册),武汉大学、吉林大学等校编,高等教育出版社,第三版,1994年4月出版 八、教学时数分配 编 目 内 容 讲授学时 第一章 绪论 2学时 第二章 物质的状态 4学时
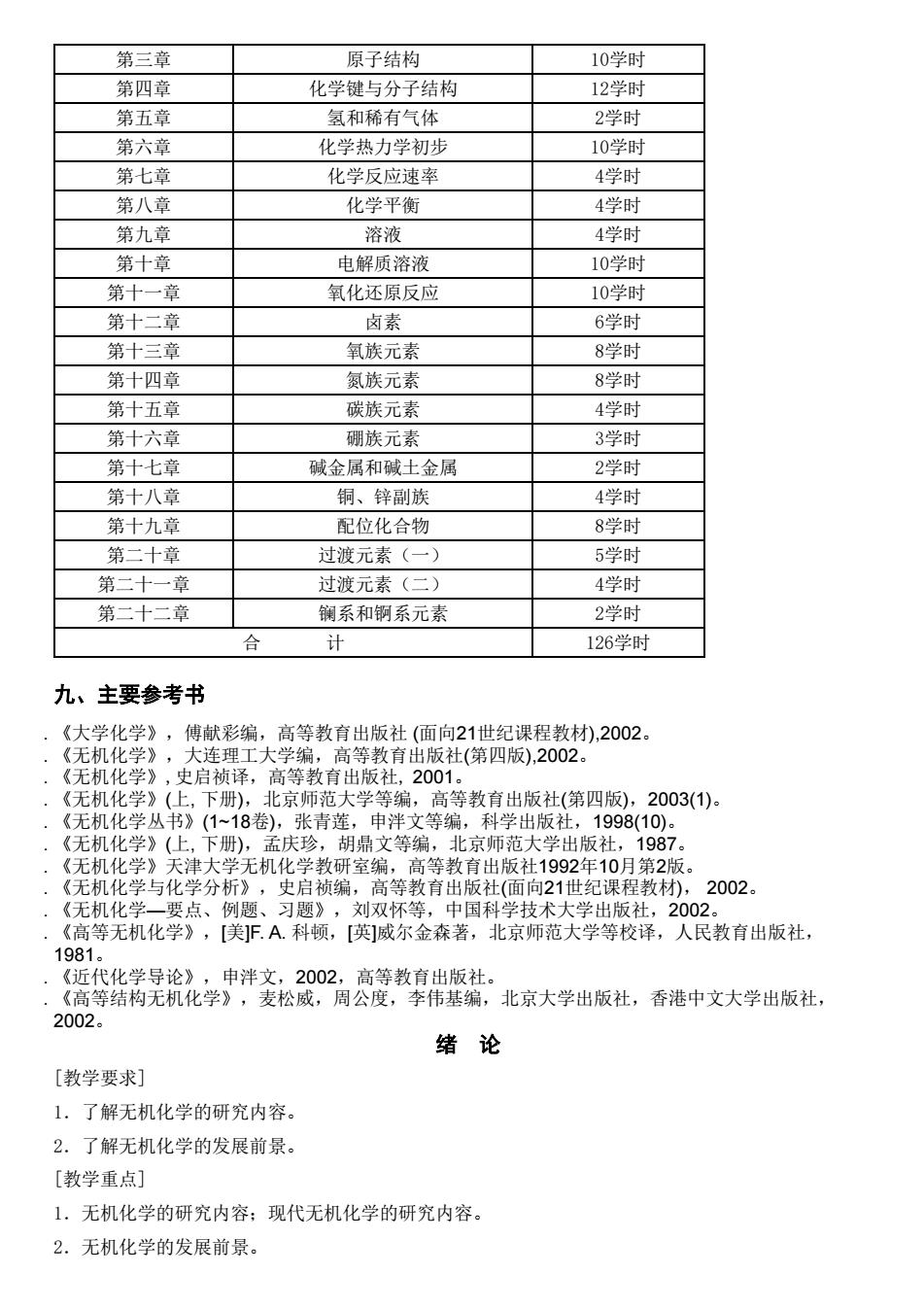
第三章 原子结构 10学时 第四章 化学键与分子结构 12学时 第五章 氢和稀有气体 2学时 第六章 化学热力学初步 10学时 第七章 化学反应速率 4学时 第八章 化学平衡 4学时 第九章 溶液 4学时 第十章 电解质溶液 10学时 第十一音 氧化还原反应 10学时 第十二章 卤素 6学时 第十三章 氧族元素 8学时 第十四章 氨族元素 8学时 第十五章 碳族元素 4学时 第十六章 硼族元素 3学时 第十十章 碱金属和威土金属 2学时 第十八章 铜、锌副族 4学时 第十九.章 配位化合物 8学时 第二十章 过渡元素(一) 5学时 第二十一章 过渡元素(二》 4学时 第二十二章 镧系和锕系元素 2学时 合 计 126学时 九、主要参考书 《大学化学》,傅献彩编,高等教育出版社(面向21世纪课程教材),2002, 《无机化学》,大连理工大学编,高等教育出版社(第四版),2002。 《无机化学》,史启祯译,高等教育出版社,2001。 《无机化学》(上,下册),北京师范大学等编,高等教育出版社(第四版),2003(1)。 《无机化学丛书》(1~18卷),张青莲,申泮文等编,科学出版社,1998(10)。 《无机化学》(上,下册),孟庆珍,胡鼎文等编,北京师范大学出版社,1987。 《无机化学》天津大学无机化学教研室编,高等教育出版社1992年10月第2版。 《无机化学与化学分析》,史启祯编,高等教育出版社(面向21世纪课程教材),2002。 《无机化学一要点、例题、习题》,刘双怀等,中国科学技术大学出版社,2002。 《高等无机化学》,[美F.A.科顿,[英]威尔金森著,北京师范大学等校译,人民教育出版社, 1981。 《近代化学导论》,申泮文,2002,高等教有出版社。 。《高等结构无机化学》,麦松威,周公度,李伟基编,北京大学出版社,香港中文大学出版社, 2002. 绪论 [教学要求] 1.了解无机化学的研究内容。 2.了解无机化学的发展前景。 [教学重点] 1.无机化学的研究内容:现代无机化学的研究内容。 2.无机化学的发展前景
第三章 原子结构 10学时 第四章 化学键与分子结构 12学时 第五章 氢和稀有气体 2学时 第六章 化学热力学初步 10学时 第七章 化学反应速率 4学时 第八章 化学平衡 4学时 第九章 溶液 4学时 第十章 电解质溶液 10学时 第十一章 氧化还原反应 10学时 第十二章 卤素 6学时 第十三章 氧族元素 8学时 第十四章 氮族元素 8学时 第十五章 碳族元素 4学时 第十六章 硼族元素 3学时 第十七章 碱金属和碱土金属 2学时 第十八章 铜、锌副族 4学时 第十九章 配位化合物 8学时 第二十章 过渡元素(一) 5学时 第二十一章 过渡元素(二) 4学时 第二十二章 镧系和锕系元素 2学时 合 计 126学时 九、主要参考书 . 《大学化学》,傅献彩编,高等教育出版社 (面向21世纪课程教材),2002。 . 《无机化学》,大连理工大学编,高等教育出版社(第四版),2002。 . 《无机化学》,史启祯译,高等教育出版社, 2001。 . 《无机化学》(上, 下册),北京师范大学等编,高等教育出版社(第四版),2003(1)。 . 《无机化学丛书》(1~18卷),张青莲,申泮文等编,科学出版社,1998(10)。 . 《无机化学》(上, 下册),孟庆珍,胡鼎文等编,北京师范大学出版社,1987。 . 《无机化学》天津大学无机化学教研室编,高等教育出版社1992年10月第2版。 . 《无机化学与化学分析》,史启祯编,高等教育出版社(面向21世纪课程教材), 2002。 . 《无机化学—要点、例题、习题》,刘双怀等,中国科学技术大学出版社,2002。 . 《高等无机化学》,[美]F. A. 科顿,[英]威尔金森著,北京师范大学等校译,人民教育出版社, 1981。 . 《近代化学导论》,申泮文,2002,高等教育出版社。 . 《高等结构无机化学》,麦松威,周公度,李伟基编,北京大学出版社,香港中文大学出版社, 2002。 绪 论 [教学要求] 1.了解无机化学的研究内容。 2.了解无机化学的发展前景。 [教学重点] 1.无机化学的研究内容;现代无机化学的研究内容。 2.无机化学的发展前景

[复习思考题] 1.无机化学的研究对象是什么?无机化学的发展前景如何? 2。学习无机化学的方法有哪些? 物质的状态 [教学要求] 1.了解物质的四态和气体的液化、液体的气化(蒸发)、沸腾。 2.掌握理想气体定律及理想气体状态方程式。 3. 掌握混合气体分压定律,了解实际气体和Van der Waals方程。 4.掌握液体蒸气压的相关计算。 5。了解晶体的基本知识 [教学重点] 1.理想气体定律,理想气体状态方程和Dolton分压定律。 2.离子键和离子晶体。 3.原子晶体和分子晶体。 4.液体的饱和蒸气压。 5.晶体与非晶体的区别,晶体的基本类型及其性质特点。 [复习思考题] 物质的四态,平衡态 理想气体状态方程式,理想气体状态方程式中气体常数的单位和取值。混合 液体 休结 定律分算公 类晶 、量装酸种,品的结的与性质的关系是什么 课后习题,教材p43页 原子结构 [教学要求] 1.掌握近代理论在解决核外电子运动状态问题上的重要结论:电子云概念,四个量子数的意义, s、p、d原子轨道和电子云分布的图象。 2.了解屏蔽效应和钻穿效应对多电子原子能级的影响,熟练掌握核外电子的排布。 3。从原子结构与元素周期系的关系,了解元素某些性质的周期性。 [教学重点] 1.核外电子运动的特殊性:核外电子运动的量子化特征(氢原子光谱和玻尔理论)。核外电子运动 的波粒二象性(德布罗衣的预言,电子的衍射试验,测不准关系)。 2.核外电子运动状态的描述:波函数、电子云及其图象表示(径向与角度分布图)。波函数、原了 轨道和电子云的区别与联系。四个量子数(主量子数,角量子数1,磁量子数m,自旋量子数 ms)
[复习思考题] 1. 无机化学的研究对象是什么?无机化学的发展前景如何? 2. 学习无机化学的方法有哪些? 物质的状态 [教学要求] 1.了解物质的四态和气体的液化、液体的气化(蒸发)、沸腾。 2.掌握理想气体定律及理想气体状态方程式。 3. 掌握混合气体分压定律,了解实际气体和 Van der Waals 方程。 4. 掌握液体蒸气压的相关计算。 5. 了解晶体的基本知识。 [教学重点] 1.理想气体定律,理想气体状态方程和Dolton 分压定律。 2.离子键和离子晶体。 3.原子晶体和分子晶体。 4.液体的饱和蒸气压。 5.晶体与非晶体的区别,晶体的基本类型及其性质特点。 [复习思考题] . 物质的四态,平衡态、理想气体状态方程式,理想气体状态方程式中气体常数R的单位和取值。混合 气体分压定律分别是什么? . 液体蒸气压的相关计算公式? . 晶体结构中晶格、晶胞的概念?晶体结构的各种类型,晶体的结构与性质的关系是什么? . 各类晶体的特性、分子间力和氢键、离子极化? . 课后习题,教材p43页 原子结构 [教学要求] 1.掌握近代理论在解决核外电子运动状态问题上的重要结论:电子云概念,四个量子数的意义, s、p、d原子轨道和电子云分布的图象。 2.了解屏蔽效应和钻穿效应对多电子原子能级的影响,熟练掌握核外电子的排布。 3.从原子结构与元素周期系的关系,了解元素某些性质的周期性。 [教学重点] 1.核外电子运动的特殊性:核外电子运动的量子化特征(氢原子光谱和玻尔理论)。核外电子运动 的波粒二象性(德布罗衣的预言,电子的衍射试验,测不准关系)。 2.核外电子运动状态的描述:波函数、电子云及其图象表示(径向与角度分布图)。波函数、原子 轨道和电子云的区别与联系。四个量子数(主量子数n,角量子数l,磁量子数m,自旋量子数 ms)

3.核外电子排布和元素周期表:多电子原子的能级(屏蔽效应,钻穿效应,近似能级图,原子能级 与原子序数关系图)。核外电子排布原理和电子排布(能量最低原理,保里原理,洪特规则)。 原子结构与元素周期性的关系(元素性质呈周期性的原因,电子层结构和周期的划分,电子层结 构和族的划分,电子层结构和元素的分区)。 4.元素某些性质的周期性,原子半径,电离势,电子亲和势,电负性。原子轨道、核外电子分布及 其与元素周期律的关系。 [复习思考题] ,原子轨道、核外电子分布及其与元素周期律的关系? ,原子结构与元素周期表和周期系的关系,原子结构与元素性质的规律性联系? .如何描述微观粒子运动特征和核外电子运动状态? .课后习题,教材p115页 化学键与分子结构 [教学要求] 1.掌握离子键和共价键的基本特征和它们的区别。 2.掌握价键理论,杂化轨道理论、价层电子对互斥理论。 3.掌握分子轨道理论的基本内容。 4,了解分子间作用力及氢键的性质和特点。 [教学重点] 1.离子键:离子键的形成、离子的特征(电荷,半径,构型)。 2.共价键:价键理论一电子配对法(本质,要点,饱和性,方向性,类型σ键、π键)。 3.杂化轨道理论和价层电子对互斥理论:杂化轨道理论的提出,杂化轨道理论的基本要点,杂化轨 道的类型及举例。 4.分子轨道理论:分子轨道理论的基本要点,分子轨道的能级图,实例一同核:H2、He2、O2 F2、N2:异核:NO、HF。 5.共价键的属性:键长,键角,键能,键级。 6.分子间的作用力和氢键。 [复习思考题] 、键参数,杂化轨道理论、分子的几何构型的知识。 察型整什么是分子轨道理论 对 课后习题,教材p210项 氢和稀有气体 [教学要求] 1.了解氢及氢化物的物理和化学性质。 2.了解稀有气体的发现简史,单质、化合物的性质及用途
3.核外电子排布和元素周期表;多电子原子的能级(屏蔽效应,钻穿效应,近似能级图,原子能级 与原子序数关系图)。核外电子排布原理和电子排布(能量最低原理,保里原理,洪特规则)。 原子结构与元素周期性的关系(元素性质呈周期性的原因,电子层结构和周期的划分,电子层结 构和族的划分,电子层结构和元素的分区)。 4.元素某些性质的周期性,原子半径,电离势,电子亲和势,电负性。原子轨道、核外电子分布及 其与元素周期律的关系。 [复习思考题] . 原子轨道、核外电子分布及其与元素周期律的关系? . 原子结构与元素周期表和周期系的关系,原子结构与元素性质的规律性联系? . 如何描述微观粒子运动特征和核外电子运动状态? . 课后习题,教材p115页 化学键与分子结构 [教学要求] 1.掌握离子键和共价键的基本特征和它们的区别。 2.掌握价键理论,杂化轨道理论、价层电子对互斥理论。 3.掌握分子轨道理论的基本内容。 4.了解分子间作用力及氢键的性质和特点。 [教学重点] 1.离子键:离子键的形成、离子的特征(电荷,半径,构型)。 2.共价键:价键理论-电子配对法(本质,要点,饱和性,方向性,类型σ键、π键)。 3.杂化轨道理论和价层电子对互斥理论:杂化轨道理论的提出,杂化轨道理论的基本要点,杂化轨 道的类型及举例。 4.分子轨道理论:分子轨道理论的基本要点,分子轨道的能级图,实例-同核:H2、He2、O2、 F2、N2;异核:NO、HF。 5.共价键的属性:键长,键角,键能,键级。 6.分子间的作用力和氢键。 [复习思考题] . 学习巩固价键理论、键参数,杂化轨道理论、分子的几何构型的知识。 . 离子键和共价键的形成和特性? . 什么是价层电子对互斥理论?什么是分子轨道理论? . 课后习题,教材p210页 氢和稀有气体 [教学要求] 1.了解氢及氢化物的物理和化学性质。 2.了解稀有气体的发现简史,单质、化合物的性质及用途

3.掌握用VSEPR理论来判断稀有气体化合物的结构。 [教学重点] 1.氢的存在,氢气的性质,氢化物 2.稀有气体的存在、性质、制备和应用,稀有气体的化合物 3.VSEPR理论判断稀有气体化合物的结构。 [复习思考题] 稀有气体化合物的性质和结构特点? ,价层电子对互斥理论如何应用于本章? ,课后习题,教材p235页 化学热力学初步 [教学要求] 1.熟悉热力学第一定律及其相关概念。 2.掌握化学反应热效应:了解熵和熵变、反应进度概念。 3.掌握热化学方程式:反应热、反应焓变的计算:盖斯定律及有关计算:吉布斯能和化学反应方向 的判断。 [教学重点] 1.化学热力学的特点,体系和环境、敞开体系、封闭体系、孤立体系的概念、状态和状态函数、广 度性质和强度性质、等温过程和等压过程、绝热过程、内能、热和功。 2.热力学第一定律:化学反应热效应:等容化学反应热和等压反应热的概念及关系、焓及焓变的概 念及计算,化学反应进度概念,热化学方程式,反应热的计算:盖斯定律及其应用、标准生成 焓。 3.吉布斯能和化学反应的方向:自发过程及其特点、熵和熵变、标准熵变的计算、吉布斯能和自发 过程关系、吉布斯一赫姆崔兹方程式:吉布斯能判断反应的自发性,标准生成吉布斯能及其计 算。 [复习思考题] 焓变化的概念及有关计算,如何用吉布斯自由能变化去判断化学反应的方向? 试由化学反应等温式求算任意态的吉布斯自由能变量以及化学反应平衡常数? ,课后习题,教材p273页 化学反应速率 [教学要求] 1.掌握化学反应速率的基本概念及表示方法。 2.掌握反应机理概念,掌握有效碰撞理论,了解过渡状态理论,掌握活化能、活化分子的概念及其 意义。 3.掌握浓度、温度、催化剂对化学反应速率的影响及浓度、温度对化学反应速率影响的定量关系: 质量作用定律,化学反应的温度因子,熟悉阿仑尼乌斯方程及其应用。 4.了解活化过度状态理论的要点:了解催化作用的特点,了解酶催化。 [教学重点]
3.掌握用VSEPR理论来判断稀有气体化合物的结构。 [教学重点] 1.氢的存在,氢气的性质,氢化物。 2.稀有气体的存在、性质、制备和应用,稀有气体的化合物。 3.VSEPR理论判断稀有气体化合物的结构。 [复习思考题] . 稀有气体化合物的性质和结构特点? . 价层电子对互斥理论如何应用于本章? . 课后习题,教材p235页 化学热力学初步 [教学要求] 1.熟悉热力学第一定律及其相关概念。 2.掌握化学反应热效应;了解熵和熵变、反应进度概念。 3.掌握热化学方程式;反应热、反应焓变的计算;盖斯定律及有关计算;吉布斯能和化学反应方向 的判断。 [教学重点] 1.化学热力学的特点,体系和环境、敞开体系、封闭体系、孤立体系的概念、状态和状态函数、广 度性质和强度性质、等温过程和等压过程、绝热过程、内能、热和功。 2.热力学第一定律;化学反应热效应:等容化学反应热和等压反应热的概念及关系、焓及焓变的概 念及计算,化学反应进度概念,热化学方程式,反应热的计算:盖斯定律及其应用、标准生成 焓。 3.吉布斯能和化学反应的方向:自发过程及其特点、熵和熵变、标准熵变的计算、吉布斯能和自发 过程关系、吉布斯—赫姆霍兹方程式;吉布斯能判断反应的自发性,标准生成吉布斯能及其计 算。 [复习思考题] . 焓变化的概念及有关计算,如何用吉布斯自由能变化去判断化学反应的方向? . 试由化学反应等温式求算任意态的吉布斯自由能变量以及化学反应平衡常数? . 课后习题,教材p273页 化学反应速率 [教学要求] 1.掌握化学反应速率的基本概念及表示方法。 2.掌握反应机理概念,掌握有效碰撞理论,了解过渡状态理论,掌握活化能、活化分子的概念及其 意义。 3.掌握浓度、温度、催化剂对化学反应速率的影响及浓度、温度对化学反应速率影响的定量关系: 质量作用定律,化学反应的温度因子,熟悉阿仑尼乌斯方程及其应用。 4.了解活化过度状态理论的要点;了解催化作用的特点,了解酶催化。 [教学重点]