
镧系元素 三、氧化态 +Ⅲ氧化态是所有Ln元素的特征氧化态。 它们失去三个电子所需的电离势较低,即能形成 稳定的+Ⅱ氧化态。 有些虽然也有+Ⅱ或+V氧化态,但都不稳定。 Ce(4f15d 6s2),Pr(486s2),Tb(4f6s2),Dy(4f106s2) 成+IV氧化态即Ce(4),Pr(4f),Tb(4f),Dy(4f8)。 Sm(4f66s2),Eu(4f76s2),Tm(4f136s2),Yb(4f146s2)能形 成+Ⅱ氧化态即Sm(4f),Eu(4f),Tm(4f13),Yb(4f4)。 从4电子层结构来看,其接近或保持全空、半满 及全满时的状态较稳定(也存在热力学及动力学因素)
三、氧化态 +III氧化态是所有Ln元素的特征氧化态。 它们失去三个电子所需的电离势较低,即能形成 稳定的+III氧化态。 有些虽然也有+II或+IV氧化态,但都不稳定。 Ce(4f15d16s2 ),Pr(4f36s2 ),Tb(4f96s2 ),Dy(4f106s2 )能形 成+IV氧化态即Ce(4f0 ),Pr(4f1 ),Tb(4f7 ),Dy(4f8 ) 。 Sm(4f66s2 ),Eu(4f76s2 ),Tm(4f136s2 ),Yb(4f146s2 )能形 成+II氧化态即Sm(4f6 ),Eu(4f7 ),Tm(4f13),Yb(4f14) 。 从4f电子层结构来看,其接近或保持全空、半满 及全满时的状态较稳定(也存在热力学及动力学因素)。 镧系元素
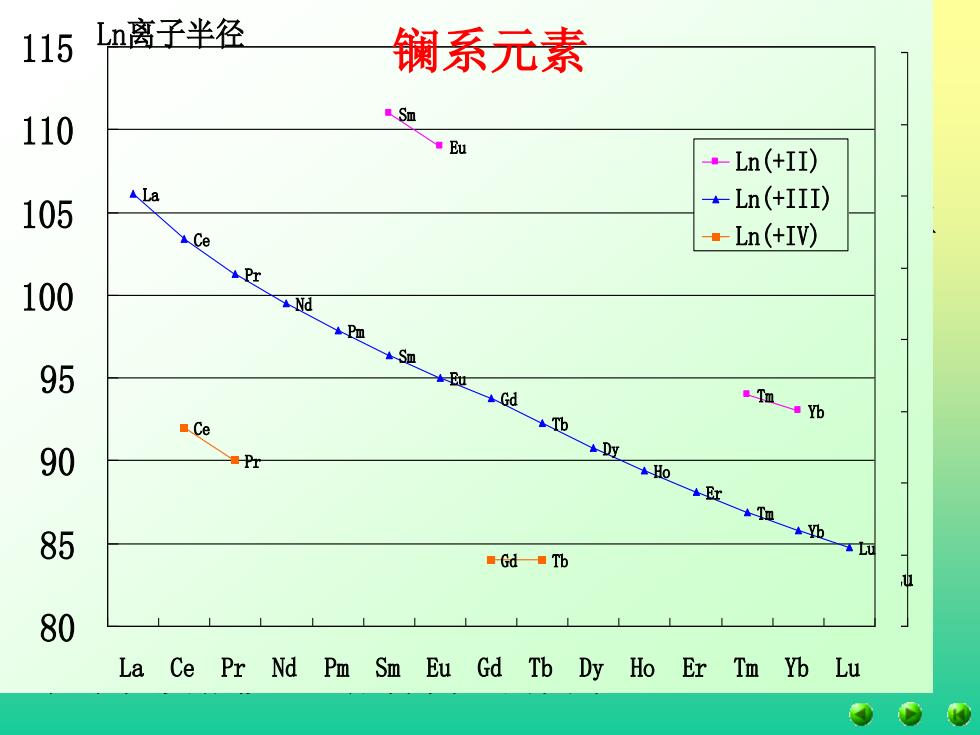
115 Ln离子半径 镧系元素 110 a Sm Eu ·Ln(+II) 105 ALa -Ln(+III) Ce ·Ln(+IV) 100 95 Tm a yb Ce 90 Pr 85 Gd Tb 80 La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
四、原子半径和离子半径 从表中的数据可以看出,从La到Lu原子半径和三 价离子半径逐渐减小。这种镧系元素的原子半径和离 子半径随着原子序数的增加而逐渐减小的现象称为镧 系收缩。 由于镧系收缩的影响,使得钇的原子半径接近 Tb和Dy,因而钇与Ln共生,并把钇归为稀土元素。 镧系收缩使IVB族中的锆与铪、VB族中的铌与 钽、VIB族的钼与钨在原子半径和离子半径较接近, 化学性质相似,造成分离上的困难。 Ln原子半径和离子半径 La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Sm Eu Tm Yb La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Ce Pr Gd Tb 80 100 120 140 160 180 200 La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Ln Ln(+II) Ln(+III) Ln(+IV) Ln原子半径 La Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Ce 170 175 180 185 190 195 200 205 210 La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Ln Ln离子半径 Sm Eu Tm Yb La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Ce Pr Gd Tb 80 85 90 95 100 105 110 115 La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Ln(+II) Ln(+III) Ln(+IV) 镧系元素