
曲商 第一节化学键的类型 Types of chemical bonds 指分子中各原子 指分子中各原子 或基团连接的方 或基团之间的相 式和顺序 用化学理论解释 用立体化学理论解麻 一、依化学健的数目 二、依成健的电子数 单链(single bond) 单电子健 双键(double bond) 两电子健 三(triple bond) 三电子健 多电子健 < H-CC-H Ha' He-cw设⊙ 三、依键的极性(polarity) 四、依成键杂化轨道(hybrid orbital) ”非极性共价健 SP杂化 SP杂化 SP杂化 1极性共价健 H-CEC-H 浴 A-B 若A=B非极性楚 若A*B极性能
2 用化学键理论解释 用立体化学理论解释 7 指分子中各原子 或基团连接的方 式和顺序 指分子中各原子 或基团之间的相 对位置,即空间 构型或立体构型 结 构 structure 内 在 结 构 intrinsic structure 外 在 结 构 extrinsic structure 8 第一节 化学键的类型 Types of chemical bonds of chemical bonds 9 一、依化学键的数目 例: C C H H H H H H C C H H H H H C C H 单键(single bond) 双键(double bond) 三键(triple bond) 10 二、依成键的电子数 例: H O O 2 + H3C CH3 单电子键 两电子键 三电子键 多电子键 11 三、依键的极性(polarity) 非极性共价键 极性共价健 C Cl H H H C O CH3 CH3 C C H H H H H H A B 例: 若 A=B 非极性键 若 A≠B 极 性 键 12 四、依成键杂化轨道(hybrid orbital ) SP 杂化 SP2杂化 SP3杂化 H C C H C C H H H H C H H H H 例:

杂化轨道的电负性(negativity): 杂化轨道中$轨道的比例及对性质的影响示家图 不同的杂化轨道吸引电子的能力不同 sp sp2 sp ★对s印归结为 28% ”S成分越女对电子的束缚力越大,杂化 轨道的电负性越大。 通定性清加 ”见下页示国 五、依成健健轴的关系 破道与的关系示家 ”σ健:成键轨道与成键原子在同一直线 x健:成健轨道与成健原子不在同一直线 s-dg ppa键 ”见下页示意田 p-do ©健与无键的比校1门 g键 π键 可以单独存在 必须与。续共存 存在手任句含共价键的分子仅存在手双、叁中 在直线上相互 QOD 重 成轨道方向平行 d-d 重叠程度较大 重叠程度较小 分布成园柱形对称 分布成块状 有对称轴并星圆柱形对称通过健轴有一个对称面
3 13 杂化轨道的电负性(negativity): 不同的杂化轨道吸引电子的能力不同。 ★ 对 spn归结为: S 成分越大 对电子的束缚力越大,杂化 轨道的电负性越大。 S 成分越小 对电子的束缚力越小,杂化 轨道的电负性越小。 ☞ 见下页示意图。 14 sp3 sp2 sp 含s比例 25% 33% 50% CH2 H C CH H C C H CH2 - C CH- C C- 稳定性增加 酸性增加 碱性增加 杂化轨道中 S 轨道的比例及对性质的影响示意图 15 五、依成键键轴的关系 σ键:成键轨道与成键原子在同一直线 π键:成键轨道与成键原子不在同一直线 ☞ 见下页示意图。 16 p-dσ键 s-s σ键 s-p σ键 s-d σ键 成键轨道与键轴的关系示意图 p-p σ键 d-d σ键 σ 键: 17 p-p π键 p-dπ键 d-dπ键 π 键: 18 σ 键与 π 键的比较-1 有对称轴并呈圆柱形对称 通过键轴有一个对称面 分布成园柱形对称 分布成块状 重叠程度较大 重叠程度较小 成键轨道方向重合 成键轨道方向平行 在直线上相互交盖 相互平行而交盖 存在于任何含共价键的分子 仅存在于双键、叁键中 可以单独存在 必须与 σ 键共存 σ 键 π 键
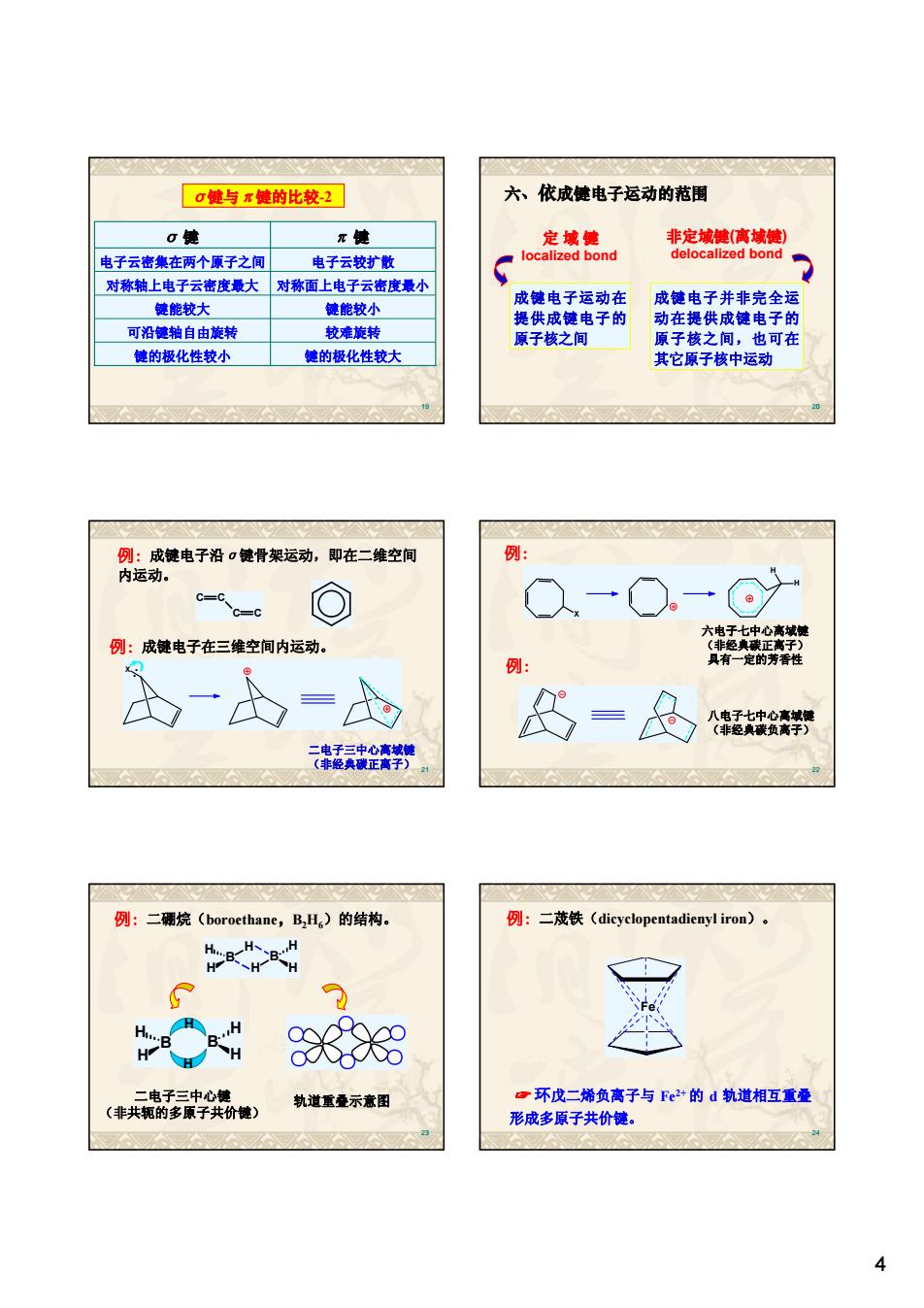
G健与x健的比较-2] 大、依成电子运动的范围 使 电子云密集在两个原子之间 电子云较扩散 对称轴上电子云密度最大 对称面上电子云密度最小 健能较大 健能较小 成健电子运动在 成键电子并非完全运 可沿德轴自由旋转 较难旋转 动在间 电子的 德的极化性较小 键的极化性较大 其它顺子核中运动 为致装电干得:黄精架运动圆在三缘之河 例: ◎ 例:成键电子在三维空间内运动。 含 公-&=d 及=&器 企债 例:二薄烷(boroethane,B,L,)的结构.。 例:二茂铁(dicyclopentadienyliron) G大o (共厨 轨道重叠示意图 。环戊二烯负离子与Fe2“的d轨道相互重叠 形成多原子共价能
4 19 σ 键 π 键 键的极化性较小 键的极化性较大 可沿键轴自由旋转 较难旋转 键能较大 键能较小 对称轴上电子云密度最大 对称面上电子云密度最小 电子云密集在两个原子之间 电子云较扩散 σ 键与 π 键的比较-2 20 六、依成键电子运动的范围 成键电子运动在 提供成键电子的 原子核之间 定 域 键 localized bond 非定域键(离域键) delocalized bond 成键电子并非完全运 动在提供成键电子的 原子核之间,也可在 其它原子核中运动 21 例:成键电子沿σ键骨架运动,即在二维空间 内运动。 C C C C 例:成键电子在三维空间内运动。 X 二电子三中心离域键 (非经典碳正离子) 22 例: 六电子七中心离域键 (非经典碳正离子) 具有一定的芳香性 X H H 例: 八电子七中心离域键 (非经典碳负离子) 23 例:二硼烷(boroethane,B2H6)的结构。 B H H B H H H H 二电子三中心键 (非共轭的多原子共价键) 轨道重叠示意图 H B H H B H H H 24 Fe 例:二荗铁(dicyclopentadienyl iron)。 ☞ 环戊二烯负离子与 Fe2+ 的 d 轨道相互重叠 形成多原子共价键

愿不将食物持体在反底中装活我 本节对有机化合物最基本的结 构理论进行了简介。 。对于学习有机化合物知识是必 须首先要掌握的内容。 四电子健) 本章目录 ■第一节化学健的类型 第二节化学键的立体方向 ,第二节化学健的立体方向 Tridimensional direction of bonds ·第三节分子变形和张力 碳碳单健的立体方向 σ键具有旋转对称性。 饱和物中C为sp杂化,呈四面体构型 当杂化轨道绕键轴旋转,从而改变所连基 团的相对位置时,不影响电子对的分布。 SP3杂化: ★这种旋转是可能的,但有一定的阻碍,即 存在旋转能鱼。 女。健旋转可能造成构意异构体的存在。 。两个饱和C原子中的C-C单健是两个s印 杂化的轨道轴向对称交盖形成的。键。 有关构异拉内容将在第3章介绍
5 25 例:下化合物反式异构体在反应中较活泼, 顺式异构体比较稳定。 C C Cl H H Hg Cl 顺-氯乙烯基氯化汞 (五中心六电子大π键 三中心四电子π键) C C H Cl H Hg Cl 反-氯乙烯基氯化汞 (五中心六电子大π键) 三中心四电子键 26 本节对有机化合物最基本的结 构理论进行了简介。 ☞ 对于学习有机化合物知识是必 须首先要掌握的内容。 27 n 第一节 化学键的类型 n 第二节 化学键的立体方向 n 第三节 分子变形和张力 本 章 目 录 28 第二节 化学键的立体方向 Tridimensional direction of bonds Tridimensional direction of bonds 29 一、碳-碳单键的立体方向 饱和物中 C 为 sp3 杂化,呈四面体构型。 ☞ 两个饱和 C 原子中的 C-C 单键是两个 sp3 杂化的轨道轴向对称交盖形成的σ键。 SP3 杂化: C H H H H 30 σ 键具有旋转对称性。 ☞ 当杂化轨道绕键轴旋转,从而改变所连基 团的相对位置时,不影响电子对的分布。 ★ 这种旋转是可能的,但有一定的阻碍,即 存在旋转能垒。 ★ σ 键旋转可能造成 构象异构体 的存在。 ☞ 有关 构象异构 内容将在第 3 章介绍
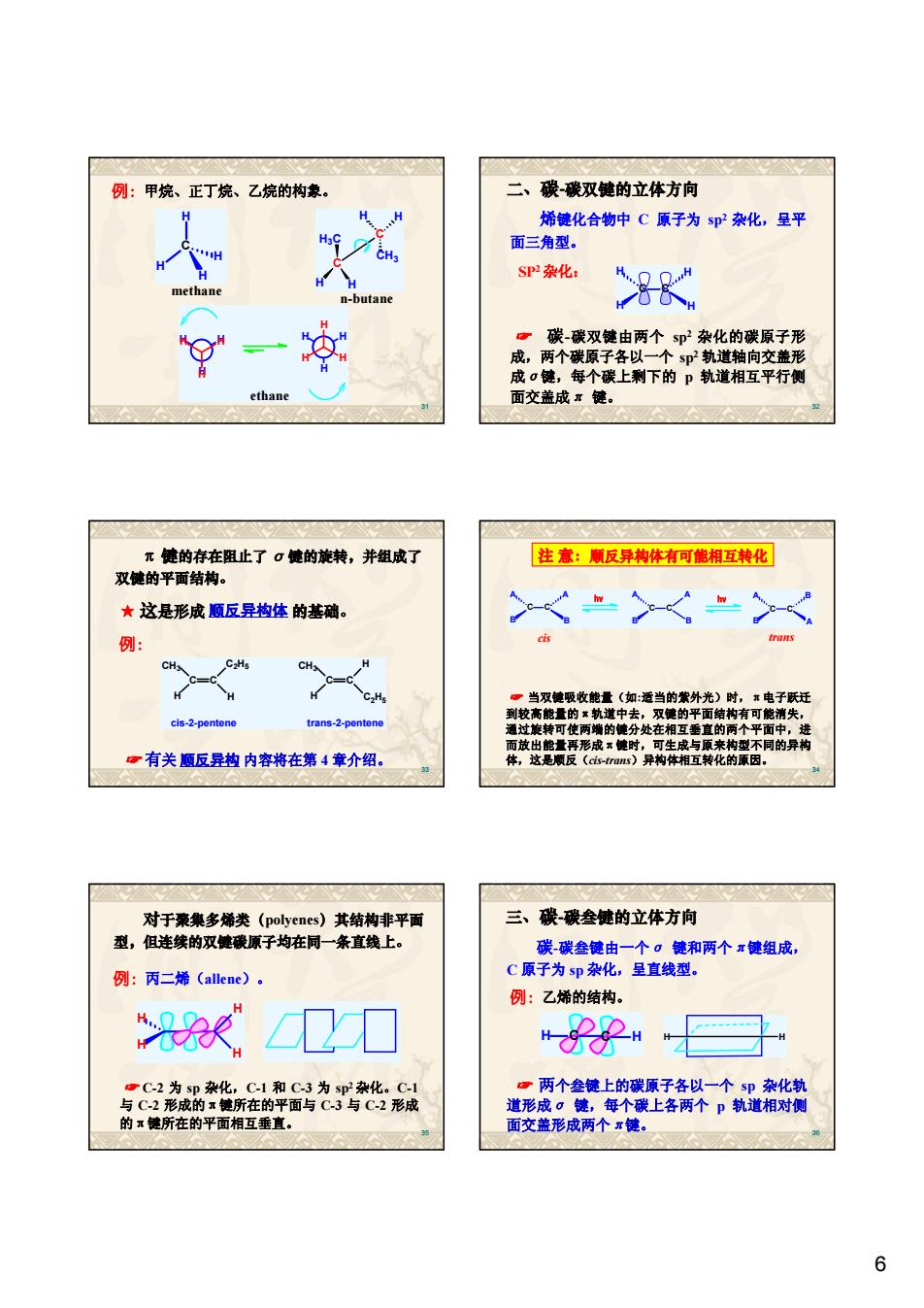
例:甲烧、正丁烷、乙烧的构象。 二、碳碳双健的立体方向 烯键化合物中C原子为sp杂化,呈平 面三角型。 SP杂化: K g一女 碳双键由两个s2杂化的碳原子形 成,两个碳原子各以一个sp轨道轴向交盖形 成口德,每个碳上剩下的p轨道相互平行侧 ethane 面交盖成健 元健的存在阻止了σ睫的旋转,并组成了 注意:顺反异构体有可能相互转化 双健的平面结构。 ★这是形成顺反异构体的基随。 cls-2-pentene trans-2-pentene 中在的 不同的异构 一有关顺反是内容将在第4章介绍。 对于豪集多稀类(polyenes)其结构非平面 三、碳碳叁健的立体方向 型,但连续的双健硬原子均在同一条直线上。 碳碳叁德由一个。健和两个使组成, 例:丙二烯(aeme)。 C原子 sp杂化,呈直线型 例:乙烯的结构。 <卫刀 与C密费所在的犁面光格形 的键所在的平面相互垂直
6 31 例:甲烷、正丁烷、乙烷的构象。 H H H H H H H H H H H H ethane C C H CH3 H H3C H H n-butane C H H H H methane 32 二、碳-碳双键的立体方向 烯键化合物中 C 原子为 sp2 杂化,呈平 面三角型。 ☞ 碳-碳双键由两个 sp2 杂化的碳原子形 成,两个碳原子各以一个 sp2 轨道轴向交盖形 成σ键,每个碳上剩下的 p 轨道相互平行侧 面交盖成π 键。 C C H H H H SP2 杂化: 33 π 键的存在阻止了 σ 键的旋转,并组成了 双键的平面结构。 ☞ 有关 顺反异构 内容将在第 4 章介绍。 ★ 这是形成 顺反异构体 的基础。 C C C2H5 H CH3 H cis-2-pentene C C H C2H5 CH3 H trans-2-pentene 例: 34 注 意:顺反异构体有可能相互转化 ☞ 当双键吸收能量(如:适当的紫外光)时,π电子跃迁 到较高能量的π轨道中去,双键的平面结构有可能消失, 通过旋转可使两端的键分处在相互垂直的两个平面中,进 而放出能量再形成π键时,可生成与原来构型不同的异构 体,这是顺反(cis-trans)异构体相互转化的原因。 C C A B A B hv C C A B A B hv C C A B B A cis trans 35 例:丙二烯(allene)。 H H H H 对于聚集多烯类(polyenes)其结构非平面 型,但连续的双键碳原子均在同一条直线上。 ☞ C-2 为 sp 杂化,C-1 和 C-3 为 sp2 杂化。C-1 与 C-2 形成的π键所在的平面与 C-3 与 C-2 形成 的π键所在的平面相互垂直。 36 三、碳-碳叁键的立体方向 碳-碳叁键由一个σ 键和两个π键组成, C 原子为 sp 杂化,呈直线型。 例:乙烯的结构。 H C C H H H ☞ 两个叁键上的碳原子各以一个 sp 杂化轨 道形成σ 键,每个碳上各两个 p 轨道相对侧 面交盖形成两个π键