
氮族通性 四、氮族元素的特性 由于价电子层为ns2np3与氧族、卤素比较,它们 若要获得三个电子而形成-Ⅲ价的离子是较困难的, 只有电负性较大的N、P能形成极少数-Ⅲ价的离子型 化合物,LiN、Mg3N2、Na3P、Ca3P,等,由于N3-、 P3离子半径大容易变型,遇水强烈水解生成NH和 PH3如: Mg3N2+6H2O===3Mg(OH)2+3NH3T Na3P+3H2O===3NaOH+3PH3T 本族元素形成正价的趋势较强,如NF3、PBrs AsFs、SbCIs、BiCL3、SbCl等,形成共价化合物是 本族元素的特征
氮族通性 四、氮族元素的特性 由于价电子层为ns2np3与氧族、卤素比较,它们 若要获得三个电子而形成-Ⅲ价的离子是较困难的, 只有电负性较大的N、P能形成极少数-Ⅲ价的离子型 化合物,Li3N、Mg3N2、Na3P、Ca3P2等,由于N3-、 P3-离子半径大容易变型,遇水强烈水解生成NH3和 PH3如: Mg3N2+6H2O===3Mg(OH)2+3NH3 Na3P+3H2O===3NaOH+3PH3 本族元素形成正价的趋势较强,如NF3、PBr5、 AsF5、SbCl5、BiCl3、SbCl3等,形成共价化合物是 本族元素的特征

氮族通性 从N到Bi,+V氧化态的稳定性递减,而+Ⅲ氧化态 的稳定性递增。 +V氧化态的氮是较强的氧化剂。除氮外从磷到 铋+V氧化态的氧化性(从+V还原到+Ⅲ)依次增强。 +V氧化态的磷儿乎不具有氧化性并且最稳定,而 +V氧化态的铋是最强的氧化剂,它的+Ⅲ氧化态最稳 定,几乎不显还原性
氮族通性 从N到Bi,+V氧化态的稳定性递减,而+Ⅲ氧化态 的稳定性递增。 +V氧化态的氮是较强的氧化剂。除氮外从磷到 铋+V氧化态的氧化性(从+V还原到+Ⅲ)依次增强。 +V氧化态的磷儿乎不具有氧化性并且最稳定,而 +V氧化态的铋是最强的氧化剂,它的+Ⅲ氧化态最稳 定,几乎不显还原性

氨及其化合物 氮 氨 氨的衍生物 氮的氧化物 亚硝酸及其盐 硝酸及其盐 光化学烟雾
氮及其化合物 氮 光 化 学 烟 雾 氨 氨 的 衍 生 物 氮 的 氧 化 物 亚硝酸及其盐 硝 酸 及 其 盐
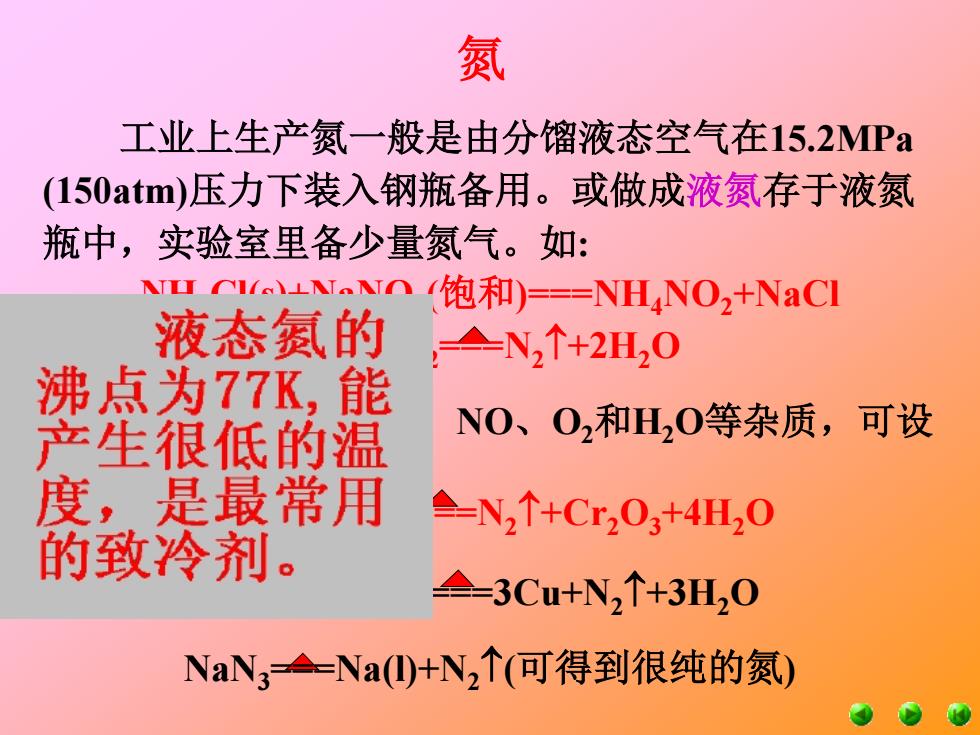
氮 工业上生产氮一般是由分馏液态空气在15.2MPa (150atm)压力下装入钢瓶备用。或做成液氮存于液氮 瓶中,实验室里备少量氮气。如: NuNn饱和)==NHNO2+NaCl 液态氨的 ,N2↑+2H20 沸点为77K,能 产生很低的温 NO、O2和H,0等杂质,可设 度,是最常用 △-N2↑+Cr203+4H20 的致冷剂。 =3Cu+N2↑+3H20 NaN3=Na①⑩+N2↑(可得到很纯的氮)
氮 工业上生产氮一般是由分馏液态空气在15.2MPa (150atm)压力下装入钢瓶备用。或做成液氮存于液氮 瓶中,实验室里备少量氮气。如: NaN3===Na(l)+N2(可得到很纯的氮) 产物中有少量NH3、NO、O2和H2O等杂质,可设 法除去。 (NH4 )2Cr2O7===N2+Cr2O3+4H2O 2NH3+3CuO===3Cu+N2+3H2O NH4Cl(s)+NaNO2 (饱和)===NH4NO2+NaCl NH4NO2===N2+2H2O

氮 氮原子间能形成多重键,因而能生成本族其它元 素所没有的化合物如叠氮化物N3),偶氮化合物(一N =N一)等。由于N2的键能很大(946kJmo),加热到 3273K时,只有0.1%离解。 N2在常温下就和锂直接反应生成Li,N,在高温时 不但能和镁、钙、铝、硼、硅等化合生成氮化物,而 且能与氧、氢直接化合。 因的原子半径小、又没有d轨道可供成键,所以 N在化合物中的配位数最多不超过4
氮 氮原子间能形成多重键,因而能生成本族其它元 素所没有的化合物如叠氮化物(N3 - ),偶氮化合物(—N =N—)等。由于N2的键能很大(946kJ·mol-1 ),加热到 3273K时,只有0.1%离解。 N2在常温下就和锂直接反应生成Li3N,在高温时 不但能和镁、钙、铝、硼、硅等化合生成氮化物,而 且能与氧、氢直接化合。 因N的原子半径小、又没有d轨道可供成键,所以 N在化合物中的配位数最多不超过4