
15 病料作 1:5~10 稀释。然后按稀释后的病料悬液量计算并加入双抗(青、链霉素),使两者 最终浓度达每毫升 1000 单位或微克,并在 4℃环境下作用 1~2 小时,离心沉淀后取上清液 作为分离培养病毒的接种材料。 2.病料接种 若用鸡胚分离、培养病毒,则多选 9~12 日龄之间的发育鸡胚。许多病毒、特别是大多 数禽病毒都能在鸡胚或鸭胚中生长繁殖。接种时应先在照蛋器下检查鸡胚是否健康、活泼, 并划出气室和接种部位。然后严格消毒接种部位和气室,用打孔器打孔后,每胚接种处理好 的病料 0.1~0.2 毫升。接种后要用石蜡将孔口封死,放 37℃环境中继续孵育 48~96 小时。 不同病毒其接种部位、方法和培养时间不尽一样。可参考后面各有关内容。 若用动物分离、培养病毒,则最好选用本种动物或自然易感动物。除此之外,常用于分 离病毒的实验动物有小白鼠、豚鼠、家兔、大白鼠等。兔子的接种常采用肌肉注射、耳静脉 注射,剂量一般是 1 毫升。小白鼠、大白鼠、豚鼠常采用腹腔注射,剂量一般为 0.2~0.5 毫升。接种动物所用病料的处理与鸡胚接种法相同。动物接种后要单独饲养,不断观察,按 照规定时间收获病毒并进行鉴定。 根据病毒种类的不同,鸡胚接种后病毒可在不同部位生长、繁殖,例如新城疫病毒在尿 囊液和羊水中、喉气管炎病毒和痘病毒在绒毛膜上含量最高。其它试验动物接种后亦是如此, 即不同种类的病毒存在于不同的部位,如猪瘟病毒接种家兔后主要存在于血液、脾脏和淋巴 结,而狂犬病毒主要存在于接种动物的脑和神经组织中。因此收获病毒时应根据其生长、存 在部位来选取不同的组织器官。 除了鸡胚和动物外,细胞体外培养也是分离病毒的常用方法,但由于所需物品,试剂和 条件要求较严格,有些病初次分离不易在人工培养细胞上生长,而且技术难度较大,因此在 一般基层单位难以开展推广应用,故不作介绍。 七、鸡胚接种技术 鸡胚接种技术用途广泛,除了可以分离培养病毒、枝原体及衣原体等病原以确诊传染病 外,还可用于病毒的鉴定,效价测定,致病力测定及制造疫苗、抗原等。因此掌握鸡胚接种 技术对进行传染病的研究和防制工作非常有用。下面介绍鸡胚接种的基本技术。 1.选胚 根据需要选用合适日龄的鸡胚,大多数病毒适于 9~12 日龄的鸡胚。鸡胚应以白色蛋壳 者为好,便于照蛋观察。鸡胚应发育正常,健康活泼,不要过大、过小或畸形蛋孵化的胚。 鸡胚应来自健康无病的鸡群,而且不能含有可抑制所接种病毒的母源抗体,最好选用 SPF 鸡胚或非免疫鸡胚。 2.照蛋定位 接种前应在照蛋器下检查鸡胚,挑出死胚和弱胚。对所有健康胚应先用红铅笔画出气室 位置,再于胚胎侧画出接种位点(进针点),接种点应避开大血管,靠近气室边缘处,离胚 头约 1cm 左右。 3.接种 照蛋定位完毕后,即可开始接种。先用碘酊将接种位点和气室消毒,再用 70﹪酒精脱 碘,然后根据需要用三棱针或 20 号针头在蛋壳上打孔。根据部位,鸡胚接种有以下几种方 法(可参照图 1) (1)尿囊腔接种 这是最常用的接种方法,鸡新城疫、减蛋综合症病毒、传染性支气管炎病毒、法氏囊病 毒等均可采用这种方法。蛋壳消毒后,先在气室上打一小孔,再于胚胎一侧近气室处所画位 点打一小孔,用带 5~7 号针头的注射器插入孔内约 1.5 厘米,接种接种材料 0.1~0.2 毫升
15 病料作 1:5~10 稀释。然后按稀释后的病料悬液量计算并加入双抗(青、链霉素),使两者 最终浓度达每毫升 1000 单位或微克,并在 4℃环境下作用 1~2 小时,离心沉淀后取上清液 作为分离培养病毒的接种材料。 2.病料接种 若用鸡胚分离、培养病毒,则多选 9~12 日龄之间的发育鸡胚。许多病毒、特别是大多 数禽病毒都能在鸡胚或鸭胚中生长繁殖。接种时应先在照蛋器下检查鸡胚是否健康、活泼, 并划出气室和接种部位。然后严格消毒接种部位和气室,用打孔器打孔后,每胚接种处理好 的病料 0.1~0.2 毫升。接种后要用石蜡将孔口封死,放 37℃环境中继续孵育 48~96 小时。 不同病毒其接种部位、方法和培养时间不尽一样。可参考后面各有关内容。 若用动物分离、培养病毒,则最好选用本种动物或自然易感动物。除此之外,常用于分 离病毒的实验动物有小白鼠、豚鼠、家兔、大白鼠等。兔子的接种常采用肌肉注射、耳静脉 注射,剂量一般是 1 毫升。小白鼠、大白鼠、豚鼠常采用腹腔注射,剂量一般为 0.2~0.5 毫升。接种动物所用病料的处理与鸡胚接种法相同。动物接种后要单独饲养,不断观察,按 照规定时间收获病毒并进行鉴定。 根据病毒种类的不同,鸡胚接种后病毒可在不同部位生长、繁殖,例如新城疫病毒在尿 囊液和羊水中、喉气管炎病毒和痘病毒在绒毛膜上含量最高。其它试验动物接种后亦是如此, 即不同种类的病毒存在于不同的部位,如猪瘟病毒接种家兔后主要存在于血液、脾脏和淋巴 结,而狂犬病毒主要存在于接种动物的脑和神经组织中。因此收获病毒时应根据其生长、存 在部位来选取不同的组织器官。 除了鸡胚和动物外,细胞体外培养也是分离病毒的常用方法,但由于所需物品,试剂和 条件要求较严格,有些病初次分离不易在人工培养细胞上生长,而且技术难度较大,因此在 一般基层单位难以开展推广应用,故不作介绍。 七、鸡胚接种技术 鸡胚接种技术用途广泛,除了可以分离培养病毒、枝原体及衣原体等病原以确诊传染病 外,还可用于病毒的鉴定,效价测定,致病力测定及制造疫苗、抗原等。因此掌握鸡胚接种 技术对进行传染病的研究和防制工作非常有用。下面介绍鸡胚接种的基本技术。 1.选胚 根据需要选用合适日龄的鸡胚,大多数病毒适于 9~12 日龄的鸡胚。鸡胚应以白色蛋壳 者为好,便于照蛋观察。鸡胚应发育正常,健康活泼,不要过大、过小或畸形蛋孵化的胚。 鸡胚应来自健康无病的鸡群,而且不能含有可抑制所接种病毒的母源抗体,最好选用 SPF 鸡胚或非免疫鸡胚。 2.照蛋定位 接种前应在照蛋器下检查鸡胚,挑出死胚和弱胚。对所有健康胚应先用红铅笔画出气室 位置,再于胚胎侧画出接种位点(进针点),接种点应避开大血管,靠近气室边缘处,离胚 头约 1cm 左右。 3.接种 照蛋定位完毕后,即可开始接种。先用碘酊将接种位点和气室消毒,再用 70﹪酒精脱 碘,然后根据需要用三棱针或 20 号针头在蛋壳上打孔。根据部位,鸡胚接种有以下几种方 法(可参照图 1) (1)尿囊腔接种 这是最常用的接种方法,鸡新城疫、减蛋综合症病毒、传染性支气管炎病毒、法氏囊病 毒等均可采用这种方法。蛋壳消毒后,先在气室上打一小孔,再于胚胎一侧近气室处所画位 点打一小孔,用带 5~7 号针头的注射器插入孔内约 1.5 厘米,接种接种材料 0.1~0.2 毫升

16 进针时针头与蛋壳应保持 30℃角,不应垂直进针,注射完毕,立即用溶化的热石蜡将注射 口和气室上小孔密封,然后放回 37℃孵化箱孵化 72~120 小时。 (2)绒毛尿囊膜接种 该方法主要用于痘病毒、喉气管炎病毒和马立克氏病毒等的分离培养。将卵壳消毒后, 先在气室上打一小孔,再于胚胎侧靠近气室处避开大血管用电烙铁或钢锯条将蛋壳打开一个 4 毫米见方的小口,用刀尖小心撬开蛋壳,不能损伤卵壳膜,形成卵窗。用针尖轻轻挑破卵 窗中心的卵壳膜,但不能损伤卵壳膜下的绒毛尿囊膜。在针尖挑破处滴一滴灭菌生理盐水或 甘油,然后用吸头在气室小孔上吸气,使胚内造成负压,这时卵窗处绒毛尿囊膜下陷而形成 人工气室,此时可见生理盐水或甘油迅速渗入。用注射器滴加 2~3 滴接种物于卵窗的绒毛 尿囊膜上,以透明胶纸封住卵窗。气室小孔用石腊密封,接种后的鸡胚平放在孵化箱中,卵 窗向上,不要转运。 (3)卵黄囊接种 此法适用于马立克氏病毒、披膜病毒、衣原体及立克次氏体的分离、培养。接种方法: 气室端蛋壳消毒后,在气室中央打一小孔,用带 7 号针头的注射器垂直刺入约 3 厘米,注射 接种物 0.1~0.2 毫升。石蜡封口,继续在 37℃孵化,每天翻蛋 2 次。 4.接种后的孵化和观察 接种后继续在 37℃孵化,每天照蛋 2 次,死胚随时取出。一般 24 小时内死亡的胚多因 创伤或细菌污染所致,故弃去不用。24 小时以后死亡的胚,取出后放 4℃冰箱,并作上记号。 接种后的孵化时间长短随病毒种类不同而不同,一般新城疫病毒、支气管炎病毒、减蛋综合 征病毒和法氏囊病毒要孵化 48~120 小时,喉气管炎病毒、马立克氏病毒要孵化 48~96 小 时,痘病毒要孵化 4~5 天,脑脊髓炎病毒要孵化至小鸡出壳。 5.收毒 接种鸡胚孵化到规定时间后,应从孵化器中取出放 4℃环境冷冻 36 小时左右,或在-10℃ 以下速冻 4 小时左右,但不得使鸡胚冻结,否则易发生溶血。冷冻完毕按下列步骤收毒: (1)鸡胚放于蛋盘或蛋架上,气室向上,用碘酊、酒精消毒后,以无菌镊子敲开气室 蛋 壳或去掉人工卵窗的透明胶纸,暴露卵膜。注意不要让卵壳碎屑掉入鸡胚内。 (2)根据接种部位,病毒种类或需要,收获相应的鸡胚材料如尿囊液、羊水、绒毛尿 囊膜、胎儿、卵黄囊等,有时需要收获全胚(除去卵黄和蛋白),如新城疫病毒、马脑炎病 毒等。 尿囊液:气室打开后,用无菌眼科镊子慢慢撕去卵壳膜,然后夹住绒毛尿囊膜轻轻提起,用 巴氏吸管刺破绒毛尿膜直接吸取尿囊液。为防止羊膜堵住吸管口,可用镊子轻轻压下羊膜及 胎鱼和,然后再吸。每个鸡胚一般可收 8 毫升左右尿囊液。 羊水:吸完尿囊液后,可用镊子夹住羊膜,将巴氏吸管直接插入羊膜腔吸取羊水,然后 再用镊子提起羊膜或压住胎儿,直至羊水收获干净。相当一部分病毒其羊水和尿囊液可以混 合,如新城疫,支气管炎、法氏囊病毒等。有些有能混合,则应将两者单收、单放。 绒毛尿囊膜:如要收获整个尿囊膜,则可在消毒、打开蛋壳、撕去壳膜后,将整个卵内 容物倒出,这时绒毛尿囊膜贴在卵壳内壁上,用镊子夹住将其撕脱下来即可。 胚胎:消毒、打开气室卵壳后,用镊子撕破卵壳膜和绒毛尿囊膜,夹起胚胎,用剪刀剪 断卵黄带,将胎儿放灭菌容器内即可。 6.鸡胚接种注意事项 (1)接种材料一般都应按每毫升 1000 单位或微克加入青、链霉素。 (2)接种位点应避开鸡胚在血管和胚头,以免针头刺伤鸡胚而造成接种后的损伤性死 亡
16 进针时针头与蛋壳应保持 30℃角,不应垂直进针,注射完毕,立即用溶化的热石蜡将注射 口和气室上小孔密封,然后放回 37℃孵化箱孵化 72~120 小时。 (2)绒毛尿囊膜接种 该方法主要用于痘病毒、喉气管炎病毒和马立克氏病毒等的分离培养。将卵壳消毒后, 先在气室上打一小孔,再于胚胎侧靠近气室处避开大血管用电烙铁或钢锯条将蛋壳打开一个 4 毫米见方的小口,用刀尖小心撬开蛋壳,不能损伤卵壳膜,形成卵窗。用针尖轻轻挑破卵 窗中心的卵壳膜,但不能损伤卵壳膜下的绒毛尿囊膜。在针尖挑破处滴一滴灭菌生理盐水或 甘油,然后用吸头在气室小孔上吸气,使胚内造成负压,这时卵窗处绒毛尿囊膜下陷而形成 人工气室,此时可见生理盐水或甘油迅速渗入。用注射器滴加 2~3 滴接种物于卵窗的绒毛 尿囊膜上,以透明胶纸封住卵窗。气室小孔用石腊密封,接种后的鸡胚平放在孵化箱中,卵 窗向上,不要转运。 (3)卵黄囊接种 此法适用于马立克氏病毒、披膜病毒、衣原体及立克次氏体的分离、培养。接种方法: 气室端蛋壳消毒后,在气室中央打一小孔,用带 7 号针头的注射器垂直刺入约 3 厘米,注射 接种物 0.1~0.2 毫升。石蜡封口,继续在 37℃孵化,每天翻蛋 2 次。 4.接种后的孵化和观察 接种后继续在 37℃孵化,每天照蛋 2 次,死胚随时取出。一般 24 小时内死亡的胚多因 创伤或细菌污染所致,故弃去不用。24 小时以后死亡的胚,取出后放 4℃冰箱,并作上记号。 接种后的孵化时间长短随病毒种类不同而不同,一般新城疫病毒、支气管炎病毒、减蛋综合 征病毒和法氏囊病毒要孵化 48~120 小时,喉气管炎病毒、马立克氏病毒要孵化 48~96 小 时,痘病毒要孵化 4~5 天,脑脊髓炎病毒要孵化至小鸡出壳。 5.收毒 接种鸡胚孵化到规定时间后,应从孵化器中取出放 4℃环境冷冻 36 小时左右,或在-10℃ 以下速冻 4 小时左右,但不得使鸡胚冻结,否则易发生溶血。冷冻完毕按下列步骤收毒: (1)鸡胚放于蛋盘或蛋架上,气室向上,用碘酊、酒精消毒后,以无菌镊子敲开气室 蛋 壳或去掉人工卵窗的透明胶纸,暴露卵膜。注意不要让卵壳碎屑掉入鸡胚内。 (2)根据接种部位,病毒种类或需要,收获相应的鸡胚材料如尿囊液、羊水、绒毛尿 囊膜、胎儿、卵黄囊等,有时需要收获全胚(除去卵黄和蛋白),如新城疫病毒、马脑炎病 毒等。 尿囊液:气室打开后,用无菌眼科镊子慢慢撕去卵壳膜,然后夹住绒毛尿囊膜轻轻提起,用 巴氏吸管刺破绒毛尿膜直接吸取尿囊液。为防止羊膜堵住吸管口,可用镊子轻轻压下羊膜及 胎鱼和,然后再吸。每个鸡胚一般可收 8 毫升左右尿囊液。 羊水:吸完尿囊液后,可用镊子夹住羊膜,将巴氏吸管直接插入羊膜腔吸取羊水,然后 再用镊子提起羊膜或压住胎儿,直至羊水收获干净。相当一部分病毒其羊水和尿囊液可以混 合,如新城疫,支气管炎、法氏囊病毒等。有些有能混合,则应将两者单收、单放。 绒毛尿囊膜:如要收获整个尿囊膜,则可在消毒、打开蛋壳、撕去壳膜后,将整个卵内 容物倒出,这时绒毛尿囊膜贴在卵壳内壁上,用镊子夹住将其撕脱下来即可。 胚胎:消毒、打开气室卵壳后,用镊子撕破卵壳膜和绒毛尿囊膜,夹起胚胎,用剪刀剪 断卵黄带,将胎儿放灭菌容器内即可。 6.鸡胚接种注意事项 (1)接种材料一般都应按每毫升 1000 单位或微克加入青、链霉素。 (2)接种位点应避开鸡胚在血管和胚头,以免针头刺伤鸡胚而造成接种后的损伤性死 亡

17 (3)接种点最好选在胚头左侧,因一般人均右手持注射器,注射时易往左侧倾斜,这 样不易刺伤鸡胚。 (4)接种后注射口和气室孔均应用石蜡切实密封,防止细菌污染造成死亡。死亡鸡胚 应随时取出,以免时间过长细菌繁殖并对周围鸡胚造成污染。 (5)鸡胚取出冷冻时应保持气室向上,否则收获尿囊液时很困难。 八、动物试验技术 动物试验常用于病原微生物的分离、鉴定、免疫原性测定、致病力测定,保护力测定、 感染谱测定、病原的继代保存或致弱、中和试验、半数感染量或致死量测定以及制造疫苗和 免疫血清等。下面介绍几种常用的动物试验技术。 1.常用的实验动物:兽医常用实验动物有家兔、小白鼠、豚鼠、大白鼠、鸡和鸽子等。 必要时亦可使用本种动物,如猪病用猪,羊病用牛。无论何种动物均应健康无病,不带有任 何病原微生物,如能使用 SPF 动物则更好。同时应对所试验病原体敏感。 2.动物试验技术 根据实验目的,动物试验的接种技术有皮下、皮内、肌内、腹腔、口鼻、静脉及颅内等 多种方法。动物接种前必须保定、消毒、剪毛。针头的大小根据动物种类和接种部位而定。 接种剂量小白鼠一般 0.2 毫升,大白鼠一般 0.5 毫升,家兔、鸡一般 1~2 毫升,鸽子 0.5 毫 升。 (1)动物的保定 家兔可用保定台或保定筒进行保定,也可徒手保定。徒手保定时让其侧卧于实验台上, 一手压住臀部和后腿,另一手抓住肩部和前腿。大鼠和小鼠的保定是用左手拇指捏紧双耳和 颈部皮肤,手掌和其余手指握住背部。较小的豚鼠其保定方法同大鼠或小鼠:较大或怀孕的 豚鼠,可用左手捏住头颈部皮肤及背部,右手固定其臀部和后肢。保定鸡或鸽子时让其侧卧 于实验台,右手压住翅根部和背部,左手握住两后肢大腿部。 (2)动物接种 不同部位的接种方法如下: 皮下接种:选皮下组织疏松,便于注射和易于吸收处。一般兔和豚鼠在腹部和大腿内侧, 鸡和鸽在胸部两侧,大鼠在背部或腹股沟部,羊和猪、犬在四肢内侧。注射时可于消毒后用 镊子将皮轻轻夹起,在镊子下部进针注射,注射后用酒精棉球压住注射部位再将针头拨出, 以防注射物流出。 肌肉接种:除禽类常用胸肌接种方法外,其他实验动物一般均为臀部肌肉接种。接种时 先消毒,然后将针头垂直或稍倾斜刺入肌肉内注射。 腹腔接种:该方法常用于小鼠、豚鼠或家兔。小鼠在脐后部中线附近,消毒后将针头以 几乎平行于腹中线的角度刺过皮肤和腹肌,注射时应感觉不到有阻力,否则可能在皮内或皮 下。家兔和豚鼠腹腔接种时,先从腹股沟处刺入皮下,再进针约 1 厘米左右。进入腹腔注射。 检验注射是否正确,除无阻力感外,还不应看到或摸到注射部位有鼓泡,否则可能在皮下或 皮内。 静脉注射:多用于家兔接种,可选择耳外侧背部边缘静脉,用酒精棉球涂擦或以手指用 力弹打耳边,可使耳静脉充血,怒涨,利于进针。消毒后左手拇指和食指紧捏静脉基部,无 名指和小指夹住耳尖部,以 5 号针头对准静脉先垂直进入皮肤和血管,然后将针头置于与血 管平行位置进针 1~2 厘米。轻轻抽动注射器,若有血液进入针管则说明已进入静脉,此时 松开静脉基部,慢慢注入接种材料,感到毫无阻力。若针头不回血或注射时阻力较大,则说 明针头未进入血管,应重新调整进针位置。注射时针管内千万不可进入气泡,否则会使兔血 管产生气性拴塞而引起急性死亡。注射完毕用棉球压迫针口片该,以免出血。小鼠多采用尾
17 (3)接种点最好选在胚头左侧,因一般人均右手持注射器,注射时易往左侧倾斜,这 样不易刺伤鸡胚。 (4)接种后注射口和气室孔均应用石蜡切实密封,防止细菌污染造成死亡。死亡鸡胚 应随时取出,以免时间过长细菌繁殖并对周围鸡胚造成污染。 (5)鸡胚取出冷冻时应保持气室向上,否则收获尿囊液时很困难。 八、动物试验技术 动物试验常用于病原微生物的分离、鉴定、免疫原性测定、致病力测定,保护力测定、 感染谱测定、病原的继代保存或致弱、中和试验、半数感染量或致死量测定以及制造疫苗和 免疫血清等。下面介绍几种常用的动物试验技术。 1.常用的实验动物:兽医常用实验动物有家兔、小白鼠、豚鼠、大白鼠、鸡和鸽子等。 必要时亦可使用本种动物,如猪病用猪,羊病用牛。无论何种动物均应健康无病,不带有任 何病原微生物,如能使用 SPF 动物则更好。同时应对所试验病原体敏感。 2.动物试验技术 根据实验目的,动物试验的接种技术有皮下、皮内、肌内、腹腔、口鼻、静脉及颅内等 多种方法。动物接种前必须保定、消毒、剪毛。针头的大小根据动物种类和接种部位而定。 接种剂量小白鼠一般 0.2 毫升,大白鼠一般 0.5 毫升,家兔、鸡一般 1~2 毫升,鸽子 0.5 毫 升。 (1)动物的保定 家兔可用保定台或保定筒进行保定,也可徒手保定。徒手保定时让其侧卧于实验台上, 一手压住臀部和后腿,另一手抓住肩部和前腿。大鼠和小鼠的保定是用左手拇指捏紧双耳和 颈部皮肤,手掌和其余手指握住背部。较小的豚鼠其保定方法同大鼠或小鼠:较大或怀孕的 豚鼠,可用左手捏住头颈部皮肤及背部,右手固定其臀部和后肢。保定鸡或鸽子时让其侧卧 于实验台,右手压住翅根部和背部,左手握住两后肢大腿部。 (2)动物接种 不同部位的接种方法如下: 皮下接种:选皮下组织疏松,便于注射和易于吸收处。一般兔和豚鼠在腹部和大腿内侧, 鸡和鸽在胸部两侧,大鼠在背部或腹股沟部,羊和猪、犬在四肢内侧。注射时可于消毒后用 镊子将皮轻轻夹起,在镊子下部进针注射,注射后用酒精棉球压住注射部位再将针头拨出, 以防注射物流出。 肌肉接种:除禽类常用胸肌接种方法外,其他实验动物一般均为臀部肌肉接种。接种时 先消毒,然后将针头垂直或稍倾斜刺入肌肉内注射。 腹腔接种:该方法常用于小鼠、豚鼠或家兔。小鼠在脐后部中线附近,消毒后将针头以 几乎平行于腹中线的角度刺过皮肤和腹肌,注射时应感觉不到有阻力,否则可能在皮内或皮 下。家兔和豚鼠腹腔接种时,先从腹股沟处刺入皮下,再进针约 1 厘米左右。进入腹腔注射。 检验注射是否正确,除无阻力感外,还不应看到或摸到注射部位有鼓泡,否则可能在皮下或 皮内。 静脉注射:多用于家兔接种,可选择耳外侧背部边缘静脉,用酒精棉球涂擦或以手指用 力弹打耳边,可使耳静脉充血,怒涨,利于进针。消毒后左手拇指和食指紧捏静脉基部,无 名指和小指夹住耳尖部,以 5 号针头对准静脉先垂直进入皮肤和血管,然后将针头置于与血 管平行位置进针 1~2 厘米。轻轻抽动注射器,若有血液进入针管则说明已进入静脉,此时 松开静脉基部,慢慢注入接种材料,感到毫无阻力。若针头不回血或注射时阻力较大,则说 明针头未进入血管,应重新调整进针位置。注射时针管内千万不可进入气泡,否则会使兔血 管产生气性拴塞而引起急性死亡。注射完毕用棉球压迫针口片该,以免出血。小鼠多采用尾

18 静脉注射。 脑内接种:小白鼠、雏鸡常为脑内接种的动物。以两眼或两耳连线中央偏左颅骨处将 4~ 6 号针刺入脑内约 1 厘米深,注入接种材料 0.05 毫升即可。注意严格消毒。 九、病原体的鉴定方法 各种病原微生物通过分离培养后,最终都必须通过病原鉴定才能最后得出确诊或结论。 病原体的鉴定一般包括如下内容: 1.形态鉴定:病原细菌主要通过涂片,染色后用光学显微镜(即普通显微镜)的高倍 镜头(即油镜头)观察其形态大小、染色特性、有无荚膜、芽孢、鞭毛以及存在方式等,从 而做出初步鉴定。病料中的病原体形态观察,可用各种病料组织(肝、脾、淋巴组织、血液、 胆汁、气管分泌物、胃肠内容物等)涂片、干燥后,以瑞氏染色法、姬母萨染色法或美兰染 色法染色镜检。培养后病原细菌可用蒸馏水稀释,涂片后,以革兰氏染色法染色镜检。具体 染色方法和各种病原细菌的形态特征可参考后面有关章节内容。病毒的形态特征鉴定目前主 要依靠电子显微镜观察,一般基层单位难以做到。 2.培养特性鉴定:对于细菌主要是检查其人工培养所适宜的培养基种类(普通培养基, 鉴别培养基及特殊培养基等)、培养条件( 温度、氧气及时间等)、生长特性(菌落形态、 大小、色泽、粘度、光滑度、是否溶血、菌液是否混浊或有沉淀等、有无毒素产生以及噬菌 体类型等)。对于病毒则主要是检查其生长繁殖所适宜的易感动物、细胞或禽胚、最佳生长 条件(细胞的种类、各种营养成份及特殊成份、禽胚的种类及日龄、温度等)和生长特性(细 胞是否产生病变、复制周期长短及病毒滴度出现峰值的时间、禽胚是否发生各种病变或死亡、 干扰作用、血细胞吸附作用,病毒复制的部位及方式等)。具体鉴定方法可参照后面各有关 章节。 3.生化鉴定:此项内容主要是针对病原性细菌,包括各种糖类的发酵试验,某些特殊 物质的产生或利用试验等,具体方法可参考各章节有关内容。 4.理化特性鉴定:理化特性是病原微生物的基本特征,也是进行病原分类和鉴定的主 要依据之一。 理化特性主要包括核酸类型及存在方式、G+C 含量、蛋白质多肽的含量及类型、酶的 种类及含量、脂质含量、碳水化合物(糖和多糖)含量以及其他成分的含量等。除此之外, 细菌还应包括抗原分析(表面抗原、鞭毛抗原、菌毛抗原、荚膜抗原、芽孢抗原、胞壁抗原 及胞浆抗原等),病毒则包括沉降系数、浮密度等。理化特性鉴定均需特殊条件。 5.生物学特性鉴定:主要包括感染谱、致病力、毒力、免疫性、血凝性、生物型、抵 抗力(对外界环境因素、物理化学因素、消毒药物及抗微生物药物的敏感性)等。 6.血清学鉴定:主要根据免疫学原理,利用特异免疫抗体对病原微生物进行鉴定。血 清学鉴定方法包括凝集反应(试管凝集和平板凝集)沉淀反应(试管沉淀和琼脂扩散沉淀反 应)、血凝抑制反应、中和反应、间接血凝、免疫电泳、荧光抗体技术、酶标抗体技术、放 射免疫技术、补体结合反应、红细胞吸附及吸附抑制试验,免疫粘附血凝试验,协同凝集试 验及其他抗体标记技术等。这些鉴定方法有的比较简便,如凝集反应,沉淀反应,琼扩反应, 血凝抑制反应等,在本教材各有关章节中均有介绍。其他一些方法均较复杂或需一定试验条 件,可参考其他教材。 7.其他鉴定方法:随着分子生物学理论和技术的迅速发展,鉴定病原微生物的方法也 不断增加,而且更加特异和敏感,例如目前已进入实用阶段的核酸杂交(核酸探针)技术、 体外核酸扩增技术(聚合酶链反应,PCR)酶切图谱、限制性酶切片段长度多态性分析(RFLP) 和核酸序列测定技术等。当然,这些鉴定方法适合各种病原微生物,但一般只有在设备齐全 的实验室才能进行
18 静脉注射。 脑内接种:小白鼠、雏鸡常为脑内接种的动物。以两眼或两耳连线中央偏左颅骨处将 4~ 6 号针刺入脑内约 1 厘米深,注入接种材料 0.05 毫升即可。注意严格消毒。 九、病原体的鉴定方法 各种病原微生物通过分离培养后,最终都必须通过病原鉴定才能最后得出确诊或结论。 病原体的鉴定一般包括如下内容: 1.形态鉴定:病原细菌主要通过涂片,染色后用光学显微镜(即普通显微镜)的高倍 镜头(即油镜头)观察其形态大小、染色特性、有无荚膜、芽孢、鞭毛以及存在方式等,从 而做出初步鉴定。病料中的病原体形态观察,可用各种病料组织(肝、脾、淋巴组织、血液、 胆汁、气管分泌物、胃肠内容物等)涂片、干燥后,以瑞氏染色法、姬母萨染色法或美兰染 色法染色镜检。培养后病原细菌可用蒸馏水稀释,涂片后,以革兰氏染色法染色镜检。具体 染色方法和各种病原细菌的形态特征可参考后面有关章节内容。病毒的形态特征鉴定目前主 要依靠电子显微镜观察,一般基层单位难以做到。 2.培养特性鉴定:对于细菌主要是检查其人工培养所适宜的培养基种类(普通培养基, 鉴别培养基及特殊培养基等)、培养条件( 温度、氧气及时间等)、生长特性(菌落形态、 大小、色泽、粘度、光滑度、是否溶血、菌液是否混浊或有沉淀等、有无毒素产生以及噬菌 体类型等)。对于病毒则主要是检查其生长繁殖所适宜的易感动物、细胞或禽胚、最佳生长 条件(细胞的种类、各种营养成份及特殊成份、禽胚的种类及日龄、温度等)和生长特性(细 胞是否产生病变、复制周期长短及病毒滴度出现峰值的时间、禽胚是否发生各种病变或死亡、 干扰作用、血细胞吸附作用,病毒复制的部位及方式等)。具体鉴定方法可参照后面各有关 章节。 3.生化鉴定:此项内容主要是针对病原性细菌,包括各种糖类的发酵试验,某些特殊 物质的产生或利用试验等,具体方法可参考各章节有关内容。 4.理化特性鉴定:理化特性是病原微生物的基本特征,也是进行病原分类和鉴定的主 要依据之一。 理化特性主要包括核酸类型及存在方式、G+C 含量、蛋白质多肽的含量及类型、酶的 种类及含量、脂质含量、碳水化合物(糖和多糖)含量以及其他成分的含量等。除此之外, 细菌还应包括抗原分析(表面抗原、鞭毛抗原、菌毛抗原、荚膜抗原、芽孢抗原、胞壁抗原 及胞浆抗原等),病毒则包括沉降系数、浮密度等。理化特性鉴定均需特殊条件。 5.生物学特性鉴定:主要包括感染谱、致病力、毒力、免疫性、血凝性、生物型、抵 抗力(对外界环境因素、物理化学因素、消毒药物及抗微生物药物的敏感性)等。 6.血清学鉴定:主要根据免疫学原理,利用特异免疫抗体对病原微生物进行鉴定。血 清学鉴定方法包括凝集反应(试管凝集和平板凝集)沉淀反应(试管沉淀和琼脂扩散沉淀反 应)、血凝抑制反应、中和反应、间接血凝、免疫电泳、荧光抗体技术、酶标抗体技术、放 射免疫技术、补体结合反应、红细胞吸附及吸附抑制试验,免疫粘附血凝试验,协同凝集试 验及其他抗体标记技术等。这些鉴定方法有的比较简便,如凝集反应,沉淀反应,琼扩反应, 血凝抑制反应等,在本教材各有关章节中均有介绍。其他一些方法均较复杂或需一定试验条 件,可参考其他教材。 7.其他鉴定方法:随着分子生物学理论和技术的迅速发展,鉴定病原微生物的方法也 不断增加,而且更加特异和敏感,例如目前已进入实用阶段的核酸杂交(核酸探针)技术、 体外核酸扩增技术(聚合酶链反应,PCR)酶切图谱、限制性酶切片段长度多态性分析(RFLP) 和核酸序列测定技术等。当然,这些鉴定方法适合各种病原微生物,但一般只有在设备齐全 的实验室才能进行
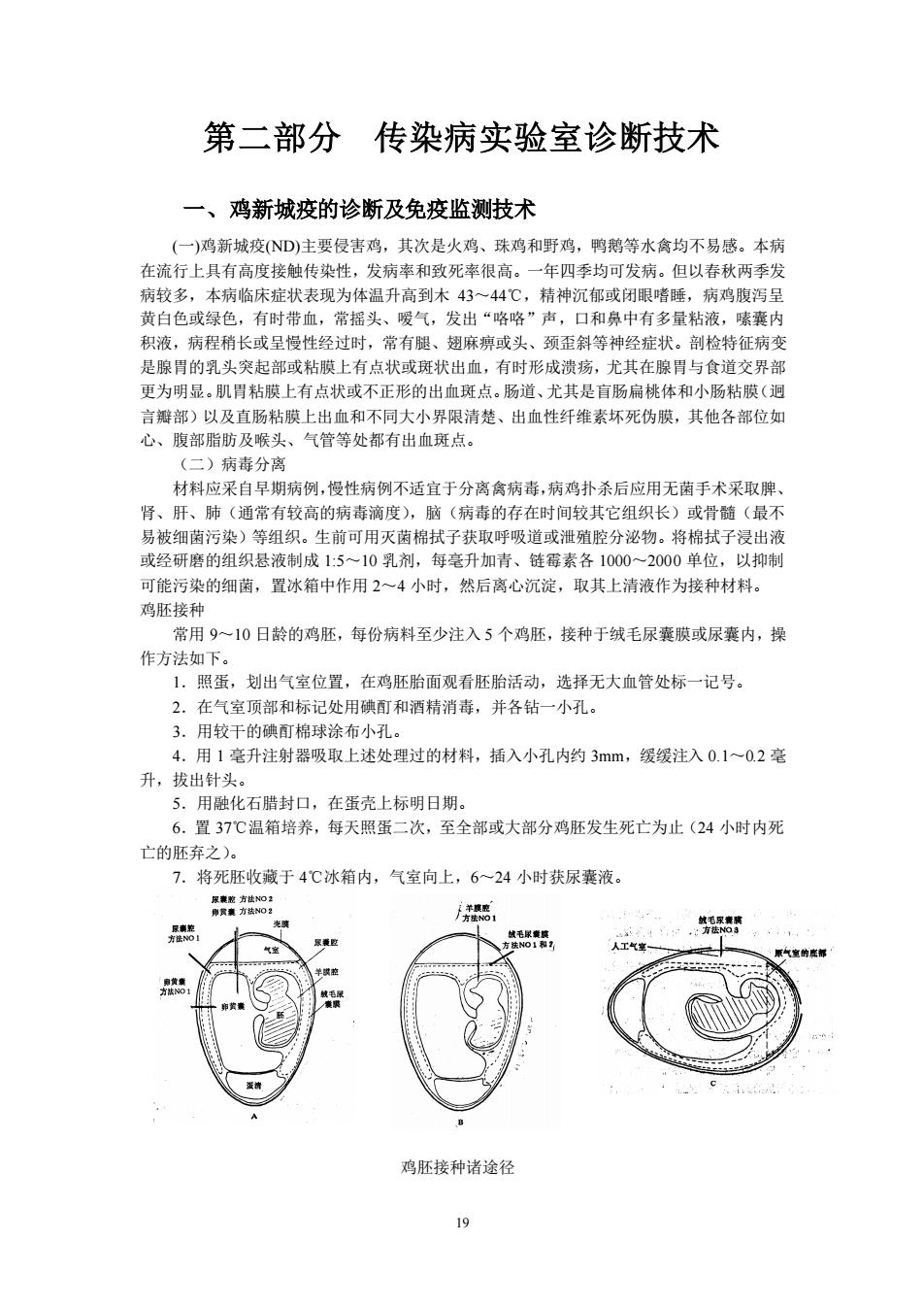
19 第二部分 传染病实验室诊断技术 一、鸡新城疫的诊断及免疫监测技术 (一)鸡新城疫(ND)主要侵害鸡,其次是火鸡、珠鸡和野鸡,鸭鹅等水禽均不易感。本病 在流行上具有高度接触传染性,发病率和致死率很高。一年四季均可发病。但以春秋两季发 病较多,本病临床症状表现为体温升高到木 43~44℃,精神沉郁或闭眼嗜睡,病鸡腹泻呈 黄白色或绿色,有时带血,常摇头、嗳气,发出“咯咯”声,口和鼻中有多量粘液,嗉囊内 积液,病程稍长或呈慢性经过时,常有腿、翅麻痹或头、颈歪斜等神经症状。剖检特征病变 是腺胃的乳头突起部或粘膜上有点状或斑状出血,有时形成溃疡,尤其在腺胃与食道交界部 更为明显。肌胃粘膜上有点状或不正形的出血斑点。肠道、尤其是盲肠扁桃体和小肠粘膜(迥 言瓣部)以及直肠粘膜上出血和不同大小界限清楚、出血性纤维素坏死伪膜,其他各部位如 心、腹部脂肪及喉头、气管等处都有出血斑点。 (二)病毒分离 材料应采自早期病例,慢性病例不适宜于分离禽病毒,病鸡扑杀后应用无菌手术采取脾、 肾、肝、肺(通常有较高的病毒滴度),脑(病毒的存在时间较其它组织长)或骨髓(最不 易被细菌污染)等组织。生前可用灭菌棉拭子获取呼吸道或泄殖腔分泌物。将棉拭子浸出液 或经研磨的组织悬液制成 1:5~10 乳剂,每毫升加青、链霉素各 1000~2000 单位,以抑制 可能污染的细菌,置冰箱中作用 2~4 小时,然后离心沉淀,取其上清液作为接种材料。 鸡胚接种 常用 9~10 日龄的鸡胚,每份病料至少注入 5 个鸡胚,接种于绒毛尿囊膜或尿囊内,操 作方法如下。 1.照蛋,划出气室位置,在鸡胚胎面观看胚胎活动,选择无大血管处标一记号。 2.在气室顶部和标记处用碘酊和酒精消毒,并各钻一小孔。 3.用较干的碘酊棉球涂布小孔。 4.用 1 毫升注射器吸取上述处理过的材料,插入小孔内约 3mm,缓缓注入 0.1~0.2 毫 升,拔出针头。 5.用融化石腊封口,在蛋壳上标明日期。 6.置 37℃温箱培养,每天照蛋二次,至全部或大部分鸡胚发生死亡为止(24 小时内死 亡的胚弃之)。 7.将死胚收藏于 4℃冰箱内,气室向上,6~24 小时获尿囊液。 鸡胚接种诸途径
19 第二部分 传染病实验室诊断技术 一、鸡新城疫的诊断及免疫监测技术 (一)鸡新城疫(ND)主要侵害鸡,其次是火鸡、珠鸡和野鸡,鸭鹅等水禽均不易感。本病 在流行上具有高度接触传染性,发病率和致死率很高。一年四季均可发病。但以春秋两季发 病较多,本病临床症状表现为体温升高到木 43~44℃,精神沉郁或闭眼嗜睡,病鸡腹泻呈 黄白色或绿色,有时带血,常摇头、嗳气,发出“咯咯”声,口和鼻中有多量粘液,嗉囊内 积液,病程稍长或呈慢性经过时,常有腿、翅麻痹或头、颈歪斜等神经症状。剖检特征病变 是腺胃的乳头突起部或粘膜上有点状或斑状出血,有时形成溃疡,尤其在腺胃与食道交界部 更为明显。肌胃粘膜上有点状或不正形的出血斑点。肠道、尤其是盲肠扁桃体和小肠粘膜(迥 言瓣部)以及直肠粘膜上出血和不同大小界限清楚、出血性纤维素坏死伪膜,其他各部位如 心、腹部脂肪及喉头、气管等处都有出血斑点。 (二)病毒分离 材料应采自早期病例,慢性病例不适宜于分离禽病毒,病鸡扑杀后应用无菌手术采取脾、 肾、肝、肺(通常有较高的病毒滴度),脑(病毒的存在时间较其它组织长)或骨髓(最不 易被细菌污染)等组织。生前可用灭菌棉拭子获取呼吸道或泄殖腔分泌物。将棉拭子浸出液 或经研磨的组织悬液制成 1:5~10 乳剂,每毫升加青、链霉素各 1000~2000 单位,以抑制 可能污染的细菌,置冰箱中作用 2~4 小时,然后离心沉淀,取其上清液作为接种材料。 鸡胚接种 常用 9~10 日龄的鸡胚,每份病料至少注入 5 个鸡胚,接种于绒毛尿囊膜或尿囊内,操 作方法如下。 1.照蛋,划出气室位置,在鸡胚胎面观看胚胎活动,选择无大血管处标一记号。 2.在气室顶部和标记处用碘酊和酒精消毒,并各钻一小孔。 3.用较干的碘酊棉球涂布小孔。 4.用 1 毫升注射器吸取上述处理过的材料,插入小孔内约 3mm,缓缓注入 0.1~0.2 毫 升,拔出针头。 5.用融化石腊封口,在蛋壳上标明日期。 6.置 37℃温箱培养,每天照蛋二次,至全部或大部分鸡胚发生死亡为止(24 小时内死 亡的胚弃之)。 7.将死胚收藏于 4℃冰箱内,气室向上,6~24 小时获尿囊液。 鸡胚接种诸途径