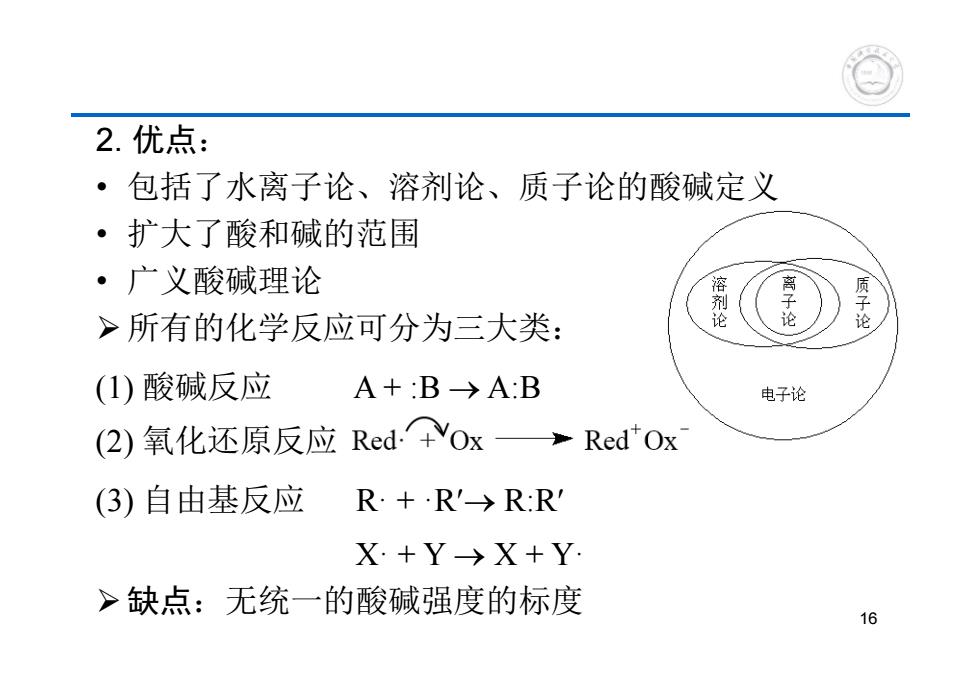
2.优点: ·包括了水离子论、溶剂论、质子论的酸碱定义 ·扩大了酸和碱的范围 ·广义酸碱理论 溶 >所有的化学反应可分为三大类: 论 质子论 (1)酸碱反应 A+:B→A:B 电子论 (2)氧化还原反应Red.vox >Red"Ox (3)自由基反应 R+R'→R:R X+Y→X+Y >缺点:无统一的酸碱强度的标度 16
2. 优点: • 包括了水离子论、溶剂论、质子论的酸碱定义 • 扩大了酸和碱的范围 • 广义酸碱理论 所有的化学反应可分为三大类: (1) 酸碱反应 A + :B A:B (2) 氧化还原反应 (3) 自由基反应 R· + ·R R:R X· + Y X + Y· 缺点:无统一的酸碱强度的标度 16

>用酸碱电子理论定义的反应类型: (I)酸碱加合反应(adduct reaction): FeBr3(s)+Br(aq)FeBra(aq) (2)酸取代反应(substitution reaction of acid): CuNH3)+4H一Cu2++4NHt (3)碱取代反应(substitution reaction of base): Cu(NH,)+2OH"-Cu(OH),+4NH, (4)双取代反应(both substitution reaction): Ba(OH)2+H2SO4 BaSO41+2H2O 17
用酸碱电子理论定义的反应类型: (1) 酸碱加合反应 (adduct reaction): (2) 酸取代反应 (substitution reaction of acid): (3) 碱取代反应 (substitution reaction of base): (4) 双取代反应 (both substitution reaction): 17

§3.2弱酸弱碱的电离平衡衡斯 一、E 电离学说(Theory of Ionization) 1.Arrheniust电离学说 >背景和实验依据: ·Raoult:lmol/L NaCl(aq)冰点下降为lmol/L蔗糖溶液的两倍 ·van'tHof:lmol/L NaCl(aq)渗透压为lmol/L蔗糖溶液的两倍 ·Faraday:酸、碱、盐溶液在电流通过时化合物分离为离子。 >导电机理: ·电解质溶液或熔体中离子的迁移 ·带相反电荷的离子是独立存在的 KNO3(aQ) KNO3(aq 蓝色 紫色 Cu(MnO4)2(aq)
一、电离学说 (Theory of Ionization) 1. Arrhenius电离学说 背景和实验依据: • Raoult:1mol/L NaCl(aq)冰点下降为1mol/L蔗糖溶液的两倍 • van’t Hoff:1mol/L NaCl(aq)渗透压为1mol/L蔗糖溶液的两倍 • Faraday:酸、碱、盐溶液在电流通过时化合物分离为离子。 导电机理: • 电解质溶液或熔体中离子的迁移 • 带相反电荷的离子是独立存在的 §3.2 弱酸弱碱的电离平衡 18

2.电解质的电离 >电离(ionization):电解质在溶液中溶剂的作用下自动 离解成可自由移动的带有正/负电荷的溶剂合离子。 >电离度():电解质电离出自由移动离子的分数 ·即已电离的电解质与总电解质物质的量之比值 ·电解质在溶液中只是部分电离,有效浓度,活度 ·强电解质:0.1mol/L溶液,表观电离度大于30% ·弱电解质:0.1mol/L溶液,表观电离度小于3% ·同一种电解质,其浓度越小,电离度越大 ·例如:HAc溶液,0.1mol/L,=1.34%;5×10-6mol/L,o=82% HC1溶液,0.1mol/L,o=92.6% 19
2. 电解质的电离 电离 (ionization):电解质在溶液中溶剂的作用下自动 离解成可自由移动的带有正/负电荷的溶剂合离子。 电离度 () :电解质电离出自由移动离子的分数 • 即已电离的电解质与总电解质物质的量之比值 • 电解质在溶液中只是部分电离,有效浓度,活度 • 强电解质:0.1mol/L溶液,表观电离度大于30% • 弱电解质:0.1mol/L溶液,表观电离度小于3% • 同一种电解质,其浓度越小,电离度越大 • 例如:HAc溶液, 0.1 mol/L, =1.34%; 5 106 mol/L, =82% HCl溶液, 0.1mol/L, =92.6% 19

>注意: ·“凡是盐类都是强电解质?” ×有些盐具有共价性,如Pb(CH.COO)2、HgCl,等,它 们在水溶液中电离程度小 “凡是水溶液导电不显著的化合物都不是电解质?” x溶解性小的离子化合物,如BaSO.饱和溶液,导电性 不显著,是因为BaSO4(s)溶解度太小,离子浓度太低 ·“凡是离子型的化合物都是强电解质?” √溶解的BaS04几乎全部电离为Ba2+(aq)和SO42(aq), 电离度=97.5%,即BaS0.是强电解质 20
注意: • “凡是盐类都是强电解质?” 有些盐具有共价性,如Pb(CH3COO)2、HgCl2等,它 们在水溶液中电离程度小 • “凡是水溶液导电不显著的化合物都不是电解质?” 溶解性小的离子化合物,如BaSO4饱和溶液,导电性 不显著,是因为BaSO4(s)溶解度太小,离子浓度太低 • “凡是离子型的化合物都是强电解质?” 溶解的BaSO4几乎全部电离为 Ba2+(aq) 和 SO42(aq), 电离度 = 97.5%,即BaSO4是强电解质 20