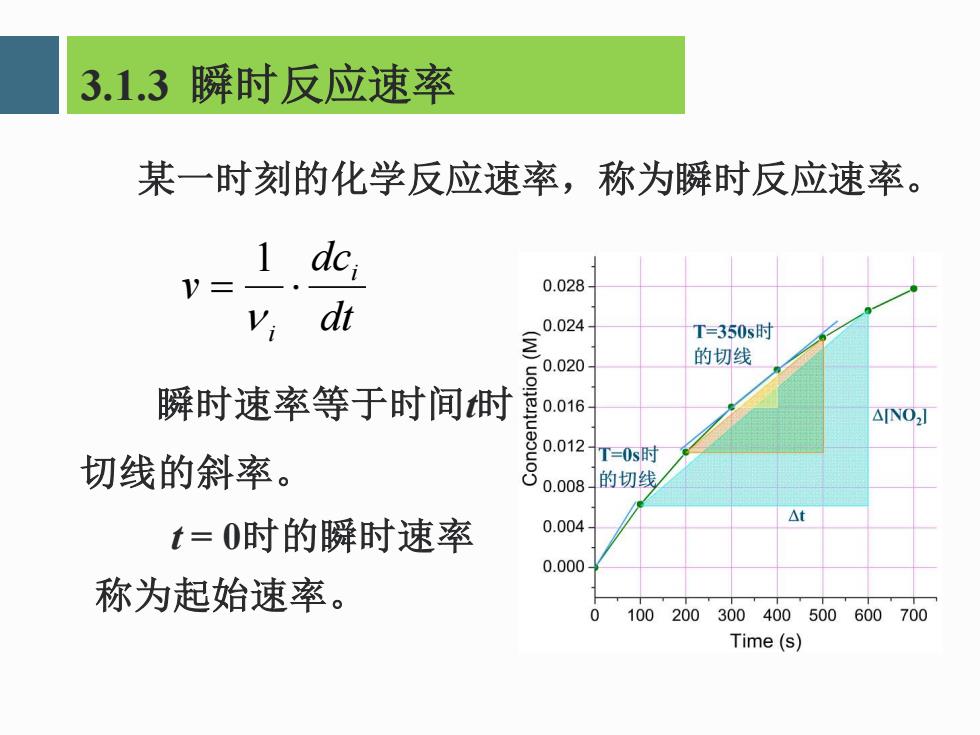
3.1.3瞬时反应速率 某一时刻的化学反应速率,称为瞬时反应速率。 1 dci V=- 0.028 v;dt 0.024 T=350s时 的切线 瞬时速率等于时间时 每0.016 △NO,J 切线的斜率。 复0.012T=0s时 0.008的切线 t=0时的瞬时速率 0.004 △t 0.000 称为起始速率。 0 100200300400500600700 Time(s)
某一时刻的化学反应速率,称为瞬时反应速率。 dt dc v i i = 1 t = 0时的瞬时速率 称为起始速率。 瞬时速率等于时间t时 切线的斜率。 3.1.3 瞬时反应速率

3.2反应速率与反应物浓度的关系 化学反应的速率方程(ate law):反应速 率与反应物浓度直接相关,表示反应速率与浓 度等之间的关系式。 aA+bB→products (a) (b) (c) (d) 9 18 18 36
3.2反应速率与反应物浓度的关系

3.2.1速率方程 对于反应aA+bB=gG+hH v=k[c(A)]imM[c(B)]" 常数k称为反应的速率常数rate contants)。 m称为反应物A的反应级数,n称为反应物B的反 应级数。k,m和n均可由实验测得
对于反应 aA + bB = gG + hH v = k[c(A)]m[c(B)]n 常数k称为反应的速率常数(rate contants)。 m称为反应物A的反应级数,n称为反应物B的反 应级数。k,m和n均可由实验测得。 3.2.1 速率方程
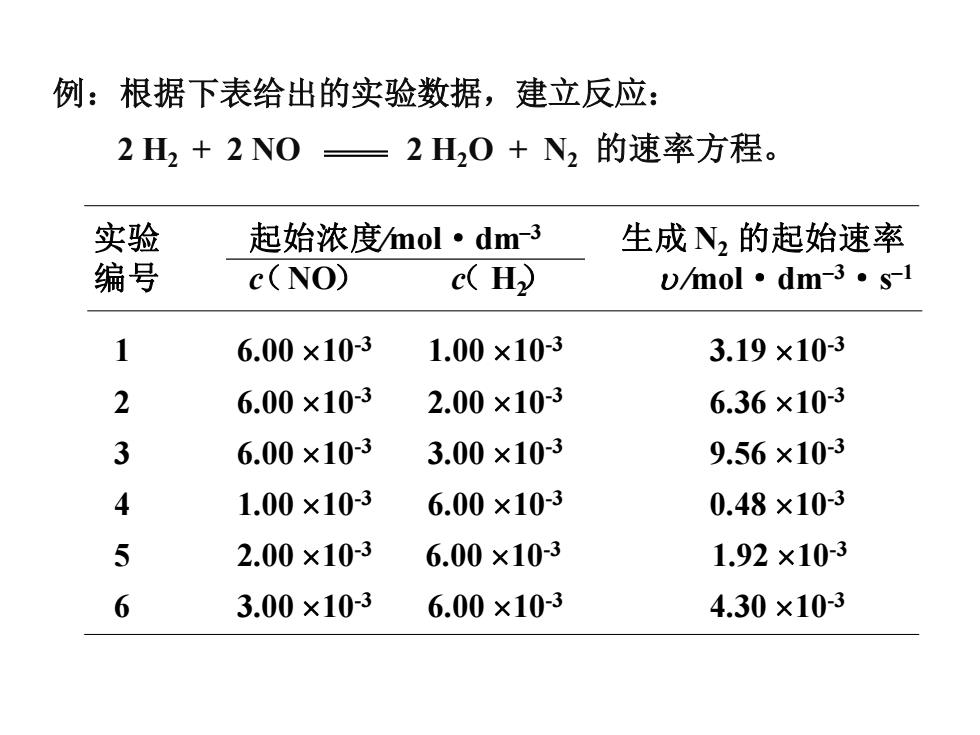
例:根据下表给出的实验数据,建立反应: 2H2+2NO= 2H20+N2的速率方程。 实验 起始浓度mol·dm-3 生成N2的起始速率 编号 c(NO) c(H2 vmol·dm-3·s-l 1 6.00×10-3 1.00×10-3 3.19×10-3 2 6.00×10-3 2.00×10-3 6.36×10-3 3 6.00×10-3 3.00×10-3 9.56×10-3 4 1.00×10-3 6.00×10-3 0.48×103 5 2.00×10-3 6.00×10-3 1.92×10-3 6 3.00×10-3 6.00×10-3 4.30×10-3
例:根据下表给出的实验数据,建立反应: 2 H2 + 2 NO 2 H2O + N2 的速率方程。 实验 起始浓度∕mol·dm–3 生成 N2 的起始速率 编号 c NO c H2 ∕mol·dm–3·s –1 1 6.00 10-3 1.00 10-3 3.19 10-3 2 6.00 10-3 2.00 10-3 6.36 10-3 3 6.00 10-3 3.00 10-3 9.56 10-3 4 1.00 10-3 6.00 10-3 0.48 10-3 5 2.00 10-3 6.00 10-3 1.92 10-3 6 3.00 10-3 6.00 10-3 4.30 10-3 ( ) ( )
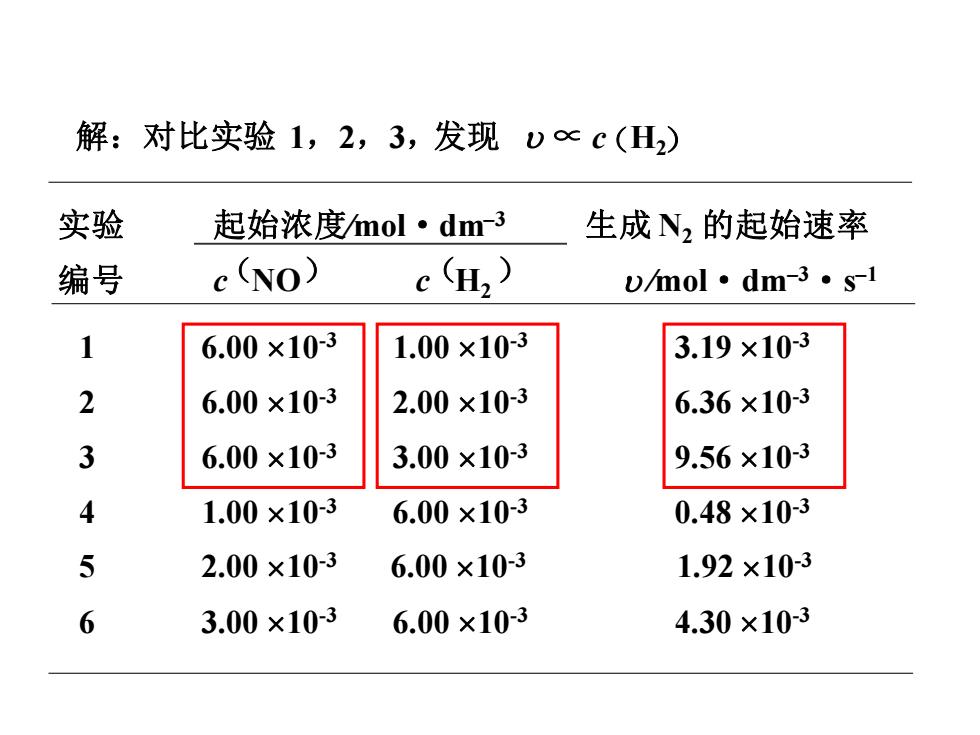
解:对比实验1,2,3,发现D∝c(H2) 实验 起始浓度mol·dm-3 生成N,的起始速率 编号 e (NO) eH2) wmol·dm-3·s-1 1 6.00×10-3 1.00×10-3 3.19×103 2 6.00×10-3 2.00×10-3 6.36×10-3 3 6.00×10-3 3.00×10-3 9.56×103 4 1.00×10-3 6.00×10-3 0.48×10-3 5 2.00×10-3 6.00×10-3 1.92×10-3 6 3.00×10-3 6.00×10-3 4.30×10-3
解:对比实验 1,2,3,发现 ∝ c(H2) 实验 起始浓度∕mol·dm–3 生成 N2 的起始速率 编号 c NO c H2 ∕mol·dm–3·s –1 1 6.00 10-3 1.00 10-3 3.19 10-3 2 6.00 10-3 2.00 10-3 6.36 10-3 3 6.00 10-3 3.00 10-3 9.56 10-3 4 1.00 10-3 6.00 10-3 0.48 10-3 5 2.00 10-3 6.00 10-3 1.92 10-3 6 3.00 10-3 6.00 10-3 4.30 10-3 ( ) ( )