
对苯二酚是常用的显影剂。 酚易被氧化的性质常用来作为抗氧剂和除氧剂。 §3醚 一、概述 除某些环醚外,醚是一类很稳定的化合物,其化学稳定性仪次于烷烃。常温下,醚对于 活泼金属、碱、氧化剂、还原剂等【分稳定。但醚仍可发尘一些特殊的反应。 二、醚键的断裂 在较高温度下,强酸能使醚链断裂,使醚链断裂最有效的试剂是浓的氢碘酸(Ⅲ)。 CHsCH2OCH2CH3+HI-CHaCH2OCH2CHs CH CH2I CHsCH2OH H(过量),2CH,CH,I+H,0 醚键断裂时往往是较小的烃基生成碘代烷,例: CH CHCH2OCH2CHa HI-CHgCHCH2OH CH;CH,I CHa CH3 芳香混醚与浓Ⅲ作用时,总是断裂烷氧键,生成酚和碘代烷。 57%H1 O+-CH3 OH CH1 120-130℃ P~π共轭 键牛固,不易断 三、环氧乙烷与RMgX反应 RCH2CH OMgXH RCHCH.OH 环氧乙烷与RMgX反应,是制备增加两个碳原子的伯醇的重要方法。例: CH2MgBr+ 无水乙醚 CH2CH2CH2OMgBr H CH2CH2CH2OH §4醛和酮 一、概述 醛酮中的羰基山于π键的极化,使得氧原子上带部分负电荷,碳原子上带部分正电荷。 氧原子可以形成比较稳定的氧负离子,它较带正电荷的碳原子要稳定得多,因此反应中心是

羰基中带正电荷的碳。所以羰基易与亲核试剂进行加成反应(亲核加成反应)。 此外,受羰基的影响,与羰基直接相连的α-碳原子上的氢原子(α-H)较活泼,能发 生一系列反应。 亲核加成反应和ā-H的反应是醛、酮的两类主要化学性质。 二、亲核加成反应 1.与氢氰酸的加成反应 C=O±HCN±C一以 CN a羟基情 反应范围:醛、脂肪族甲基酮。ArCOR和ArCOAr难反应。 ā-羟基晴是很有用的中间体,它可转变为多种化合物,例如: -H20 CH3 CHsOH CH3 CH2=C-CN H2O/H H+ →CH2=C-COOCH3 (CH)CCN (CH3)2CCOOH OH (HL OH (CH3)2CCH2NH2 OH 2.与格式试剂的加成反应 >光名+k8MgX无水乙酷 OMgX H2O -R-C-OH HOMgx 个 式中R也可以是Ar。故此反应是制备结构复杂的醇的重要方法。例: CH3 CH3 CH3 CH3 Mg (CHg)2CO CH3 H2O/H CH3 干乙醚 MgBr C-OMgBr C-OH Br CHs CH3 3.与饱和亚硫酸氢钠(40%)的加成反应 醇钠 =0+Na0s-0H→ C-ONa OH SO2H SO2Na 强酸 强酸盐(白十) 产物α-羟基磺酸盐为白色结品,不溶于饱和的亚硫酸氢钠溶液中,容易分离出来:与 酸或碱共热,又可得原来的醛、酮。故此反应可用以提纯醛、酮。 1°反应范围 醛、甲基酮、七元环以下的脂环酮。 2°反应的应用 a鉴别化合物 b分离和提纯醛、酮 稀NaHCO3 R、 NaHSO3R、OH RCHO Na2SO3+CO2+H2O H-C=0 C H (R') (R) SOaNa HCI RCHO+NaCI+SO2+H2O 杂质不反应,分离去掉
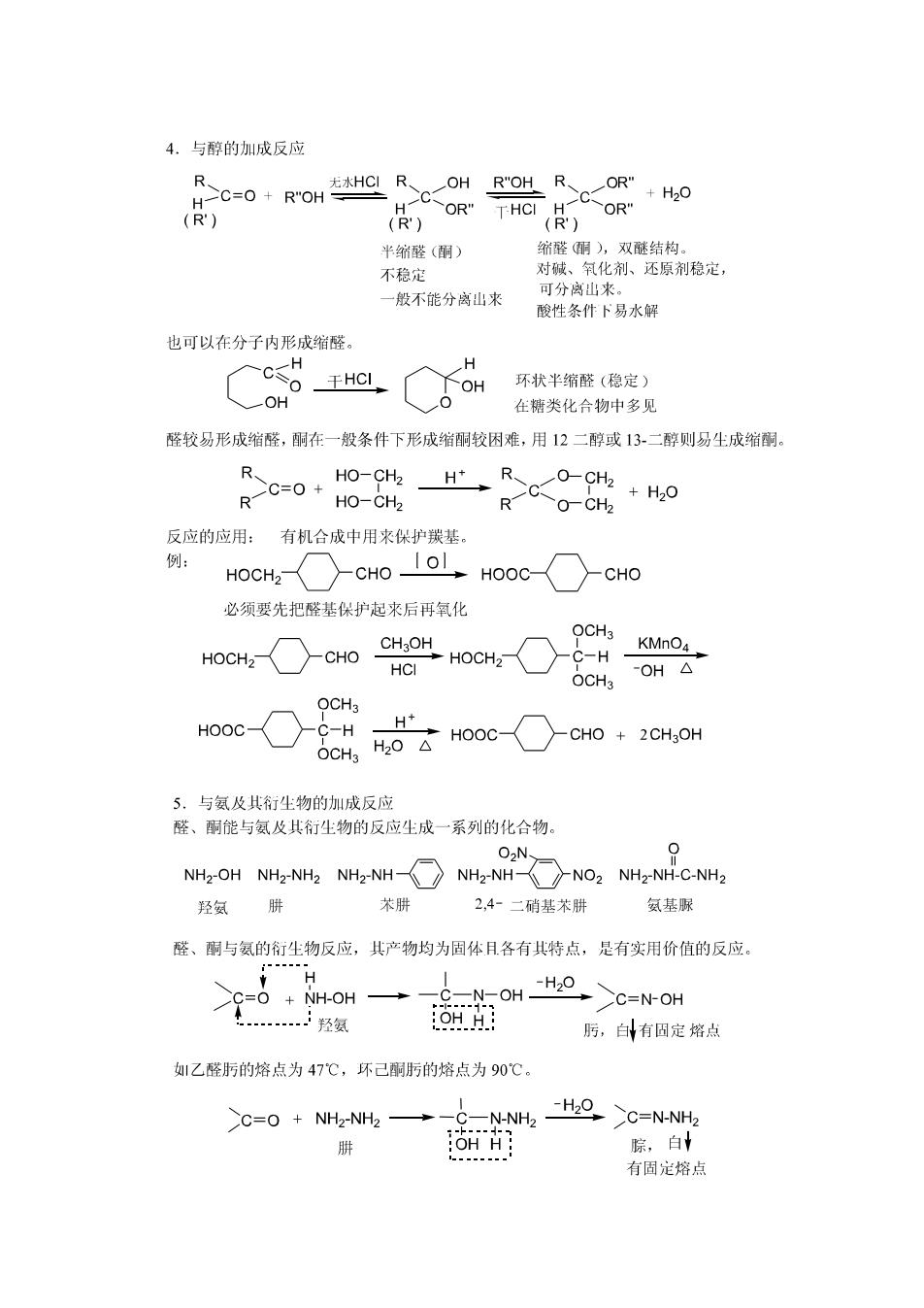
4.与醇的圳成反应 -C=O+R"OH 无水HC R、 OH R"OH R、 OR" C C +H20 H COR" THCI H OR" (R) (R) (R') 半缩醛(酮) 纺醛酮),双醚结构。 不稳定 对碱、氧化剂、还原剂稳定, 一般不能分离山来 可分离山来。 酸性条件卜易水解 也可以在分子内形成缩醛。 H c=0 H 千HCI OH 环状半缩醛(稳定) OH 在糖类化合物中多见 醛较易形成缩醛,酮在一般条件下形成缩酮较因难,用12二醇或13-二醇则易生成缩酮。 R HO-CH2 >C=0+ H→ RC-CHa R HO-CH2 +H20 R O-CH2 反应的应用: 有机合成中用来保护羰基。 例: HOCH2 CHO、 HOOC CHO 必须要先把醛基保护起来后再氧化 OCH3 CH3O HOCH2 CHO →HOCH2 KMnO4 HCI C-H -OH△ OCHa OCH3 HOOC C-H H+ H20△ HOOC CHO 2CH3OH OCH3 5.与氨及其衍尘物的加成反应 醛、酮能与氨及其衍生物的反应生成一系列的化合物。 O2N NH2-OH NH2-NH2 NH2-NH NH2NH(广NO2 NH2-NH-C-NH2 羟氨 肼 苯肼 2,4-二硝基苯肼 氨基脲 醛、酮与氨的衍生物反应,其产物均为固体月各有其特点,是有实用价值的反应。 -H20 +NH-OH -N-OH C=N-OH 羟氨 OH H 肟,白有固定熔点 1乙醛肟的熔点为47℃,环己酮肟的熔点为90℃。 C=0 NH2-NH2->-C-N-NH2 -H20 C=N-NH2 肼 :OH H: 腙,白 有固定熔点