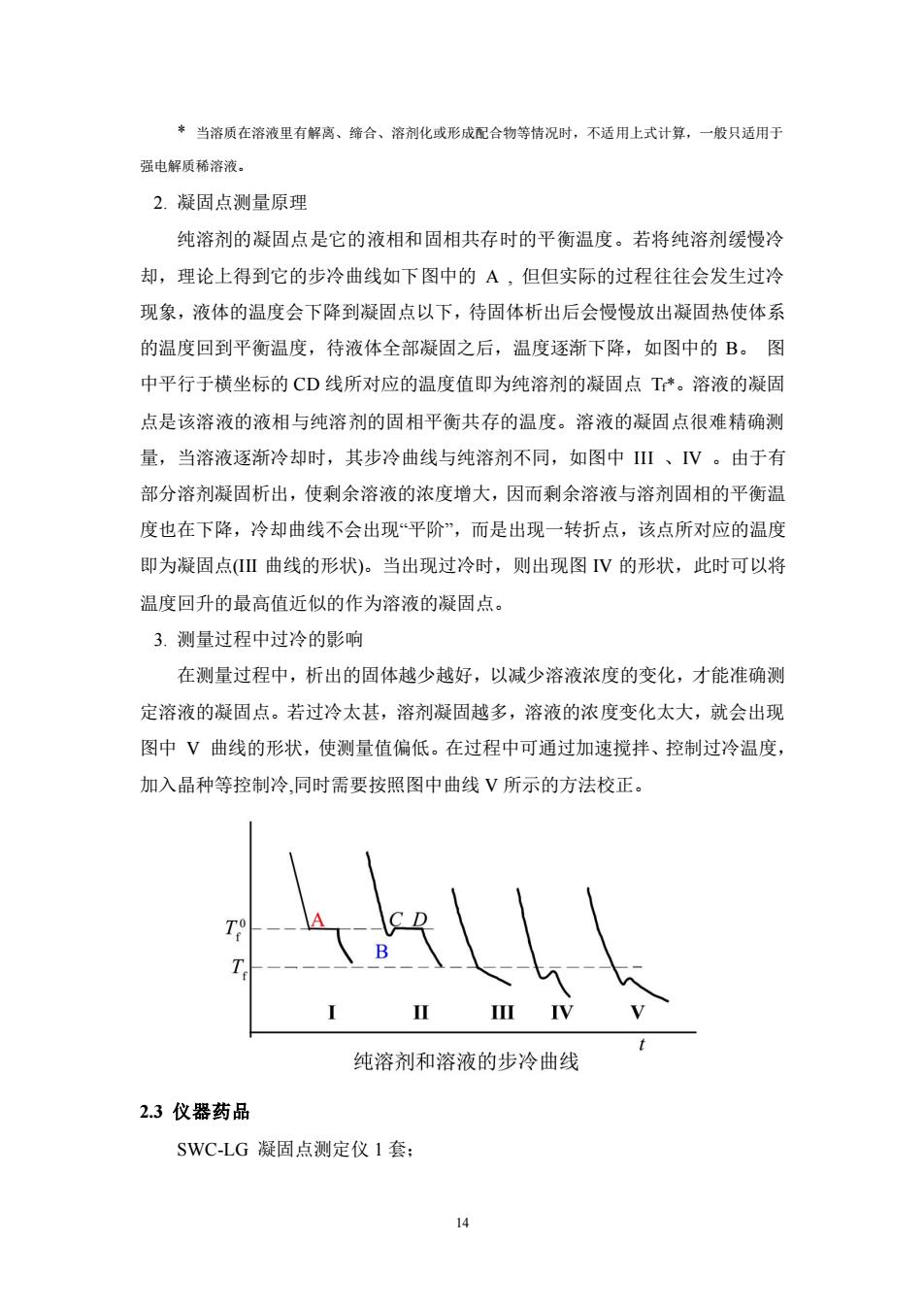
*当溶质在溶液里有解离、缔合、溶剂化或形成配合物等情况时,不适用上式计算,一般只适用于 强电解质稀溶液。 2.凝固点测量原理 纯溶剂的凝固点是它的液相和固相共存时的平衡温度。若将纯溶剂缓慢冷 却,理论上得到它的步冷曲线如下图中的A,但但实际的过程往往会发生过冷 现象,液体的温度会下降到凝固点以下,待固体析出后会慢慢放出凝固热使体系 的温度回到平衡温度,待液体全部凝固之后,温度逐渐下降,如图中的B。图 中平行于横坐标的CD线所对应的温度值即为纯溶剂的凝固点T*。溶液的凝固 点是该溶液的液相与纯溶剂的固相平衡共存的温度。溶液的凝固点很难精确测 量,当溶液逐渐冷却时,其步冷曲线与纯溶剂不同,如图中Ⅱ、V。由于有 部分溶剂凝固析出,使剩余溶液的浓度增大,因而剩余溶液与溶剂固相的平衡温 度也在下降,冷却曲线不会出现平阶”,而是出现一转折点,该点所对应的温度 即为凝固点(Ⅱ曲线的形状)。当出现过冷时,则出现图V的形状,此时可以将 温度回升的最高值近似的作为溶液的凝固点。 3.测量过程中过冷的影响 在测量过程中,析出的固体越少越好,以减少溶液浓度的变化,才能准确测 定溶液的凝固点。若过冷太甚,溶剂凝固越多,溶液的浓度变化太大,就会出现 图中V曲线的形状,使测量值偏低。在过程中可通过加速搅拌、控制过冷温度, 加入晶种等控制冷,同时需要按照图中曲线V所示的方法校正。 纯溶剂和溶液的步冷曲线 2.3仪器药品 SWC-LG凝固点测定仪1套; 14
14 * 当溶质在溶液里有解离、缔合、溶剂化或形成配合物等情况时,不适用上式计算,一般只适用于 强电解质稀溶液。 2. 凝固点测量原理 纯溶剂的凝固点是它的液相和固相共存时的平衡温度。若将纯溶剂缓慢冷 却,理论上得到它的步冷曲线如下图中的 A , 但但实际的过程往往会发生过冷 现象,液体的温度会下降到凝固点以下,待固体析出后会慢慢放出凝固热使体系 的温度回到平衡温度,待液体全部凝固之后,温度逐渐下降,如图中的 B。 图 中平行于横坐标的 CD 线所对应的温度值即为纯溶剂的凝固点 Tf*。溶液的凝固 点是该溶液的液相与纯溶剂的固相平衡共存的温度。溶液的凝固点很难精确测 量,当溶液逐渐冷却时,其步冷曲线与纯溶剂不同,如图中 III 、IV 。由于有 部分溶剂凝固析出,使剩余溶液的浓度增大,因而剩余溶液与溶剂固相的平衡温 度也在下降,冷却曲线不会出现“平阶”,而是出现一转折点,该点所对应的温度 即为凝固点(III 曲线的形状)。当出现过冷时,则出现图 IV 的形状,此时可以将 温度回升的最高值近似的作为溶液的凝固点。 3. 测量过程中过冷的影响 在测量过程中,析出的固体越少越好,以减少溶液浓度的变化,才能准确测 定溶液的凝固点。若过冷太甚,溶剂凝固越多,溶液的浓度变化太大,就会出现 图中 V 曲线的形状,使测量值偏低。在过程中可通过加速搅拌、控制过冷温度, 加入晶种等控制冷,同时需要按照图中曲线 V 所示的方法校正。 2.3 仪器药品 SWC-LG 凝固点测定仪 1 套;

数字贝克曼温度计、普通温度计(0℃~50℃):分析天平、台秤: 移液管(20mL)1支、洗耳球、烧杯; 萘(A.R) 环己烷(A.R): 2.4实验步骤 1.接好传感器,插入电源。 2.打开电源开关,温度显示为实时温度,温差显示为以20度为基准的差值 (但在10度以下显示的是实际温度)。 3.锁定基温选择量程:将传感器插入水浴槽,调节寒剂温度低于测定溶液 凝固点的2-3度,此实验寒剂温度为3.5-4.5度,然后将空气套管插入槽中,按 下锁定键。 4.用20ml移液管准确移取20ml环己烷加入凝固点测定试管中,橡胶塞塞 紧,插入传感器。 5.将凝固点试管直接插入寒剂槽中,观察温差,直至温度显示稳定不变, 此时温度就是环己烷的初测凝固点。 6.取出凝固点测定试管,用掌心加热使环己烷熔化,再次插入寒剂槽中, 缓慢搅拌,当温度降低到高于初测凝固点的0.5度时,迅速将试管取出、擦干, 插入空气套管中,记录温度显示数值。每15秒记录一次温度。 *搅拌速度调节:刚开始缓慢搅拌,在温度低于初测凝固点时,加速搅拌,待温度上升时,又恢复 缓慢搅拌。 7.重复第6步平行再做2次。 8.溶液凝固点测定:称取0.15-0.20g萘片加入凝固点测定试管,待完全溶 解后,重复以上6、7、8步骤。 9.实验结束,拔掉电源插头。 2.5注意事项 1.在测量过程中,析出的固体越少越好,以减少溶液浓度的变化,才能准 确测定溶液的凝固点。若过冷太甚,溶剂凝固越多,溶液的浓度变化太大,使测 量值偏低。在过程中可通过加速搅拌、控制过冷温度,加入晶种等控制过冷度。 2.搅拌速度的控制和温度温差仪的粗细调的固定是做好本实验的关键,每 次测定应按要求的速度搅拌,并且测溶剂与溶液凝固点时搅拌条件要完全一致。 15
15 数字贝克曼温度计、普通温度计(0℃~50℃);分析天平、台秤; 移液管(20mL)1 支、洗耳球、烧杯; 萘(A.R.); 环己烷(A.R.); 2.4 实验步骤 1. 接好传感器, 插入电源。 2. 打开电源开关,温度显示为实时温度,温差显示为以 20 度为基准的差值 (但在 10 度以下显示的是实际温度)。 3. 锁定基温选择量程:将传感器插入水浴槽,调节寒剂温度低于测定溶液 凝固点的 2-3 度,此实验寒剂温度为 3.5-4.5 度,然后将空气套管插入槽中,按 下锁定键。 4. 用 20ml 移液管准确移取 20ml 环己烷加入凝固点测定试管中,橡胶塞塞 紧,插入传感器。 5. 将凝固点试管直接插入寒剂槽中,观察温差,直至温度显示稳定不变, 此时温度就是环己烷的初测凝固点。 6. 取出凝固点测定试管,用掌心加热使环己烷熔化,再次插入寒剂槽中, 缓慢搅拌,当温度降低到高于初测凝固点的 0.5 度时,迅速将试管取出、擦干, 插入空气套管中,记录温度显示数值。每 15 秒记录一次温度。 * 搅拌速度调节:刚开始缓慢搅拌,在温度低于初测凝固点时,加速搅拌,待温度上升时,又恢复 缓慢搅拌。 7. 重复第 6 步平行再做 2 次。 8. 溶液凝固点测定:称取 0.15-0.20 g 萘片加入凝固点测定试管,待完全溶 解后,重复以上 6、7、8 步骤。 9. 实验结束,拔掉电源插头。 2.5 注意事项 1. 在测量过程中,析出的固体越少越好,以减少溶液浓度的变化,才能准 确测定溶液的凝固点。若过冷太甚,溶剂凝固越多,溶液的浓度变化太大,使测 量值偏低。在过程中可通过加速搅拌、控制过冷温度,加入晶种等控制过冷度。 2. 搅拌速度的控制和温度温差仪的粗细调的固定是做好本实验的关键,每 次测定应按要求的速度搅拌,并且测溶剂与溶液凝固点时搅拌条件要完全一致

温度-温差仪的粗细调一经确定,整个实验过程中不能再变。 3.纯水过冷度约0.7℃~1℃(视搅拌快慢),为了减少过冷度,而加入少量 晶种,每次加入晶种大小应尽量一致。 4.冷却温度对实验结果也有很大影响,过高会导致冷却太慢,过低则测不 出正确的凝固点。 5.凝固点的确定较为困难。先测一个近似凝固点,精确测量时,在接近近 似凝固点时,降温速度要减慢,到凝固点时快速搅拌。 6.千万不要过冷,若过冷太甚,凝固的溶剂过多,溶液的浓度变化过大, 所得凝固点偏低。 7.溶液的冷却曲线与纯溶剂的冷却曲线不同,不出现平台,只出现拐点, 即当析出固相,温度回升到平衡温度后,不能保持一定值,因为部分溶剂凝固后, 剩余溶液的浓度逐渐增大,平衡温度要逐渐下降。 8.用凝固点降低法测相对分子质量只适用于非挥发性溶质且非电解质的稀 溶液。 9.插入贝克曼温度计不要碰壁与触底。 2.6实验数据与处理 1.实验数据的记录 ①大气压: pa温度: ②粗测环己烷近似凝固点:(~6.547℃) 表1凝固点降低过程中精测溶剂或溶液凝固点的数值 环己烷+萘 环己烷+萘 序号 环己烷(1)/℃ 环己烷(2)/℃ (1)/℃ (2)/℃ 2 ③称量的萘的质量:m= g ④根据四组数据作出溶剂及溶液的冷却曲线图。 2.实验数据的处理 ①由环己烷的密度,计算所取环己烷的重量WA。 室温t时环己烷密度计算公式为:pt/gcm3=0.7971-0.8879×103t/℃。 6
16 温度-温差仪的粗细调一经确定,整个实验过程中不能再变。 3. 纯水过冷度约 0.7℃~1℃(视搅拌快慢),为了减少过冷度,而加入少量 晶种,每次加入晶种大小应尽量一致。 4. 冷却温度对实验结果也有很大影响,过高会导致冷却太慢,过低则测不 出正确的凝固点。 5. 凝固点的确定较为困难。先测一个近似凝固点,精确测量时,在接近近 似凝固点时,降温速度要减慢,到凝固点时快速搅拌。 6. 千万不要过冷,若过冷太甚,凝固的溶剂过多,溶液的浓度变化过大, 所得凝固点偏低。 7. 溶液的冷却曲线与纯溶剂的冷却曲线不同,不出现平台,只出现拐点, 即当析出固相,温度回升到平衡温度后,不能保持一定值,因为部分溶剂凝固后, 剩余溶液的浓度逐渐增大,平衡温度要逐渐下降。 8. 用凝固点降低法测相对分子质量只适用于非挥发性溶质且非电解质的稀 溶液。 9. 插入贝克曼温度计不要碰壁与触底。 2.6 实验数据与处理 1. 实验数据的记录 ①大气压: pa 温度: ℃ ②粗测环己烷近似凝固点:(~6.547 ℃) 表 1 凝固点降低过程中精测溶剂或溶液凝固点的数值 序号 环己烷(1)/℃ 环己烷(2)/℃ 环己烷 + 萘 (1)/℃ 环己烷 + 萘 (2)/℃ 1 2 ③称量的萘的质量:m= g ④根据四组数据作出溶剂及溶液的冷却曲线图。 2. 实验数据的处理 ①由环己烷的密度,计算所取环己烷的重量 WA 。 室温 t 时环己烷密度计算公式为∶ρt/g·cm-3=0.7971-0.8879×10-3 t/℃
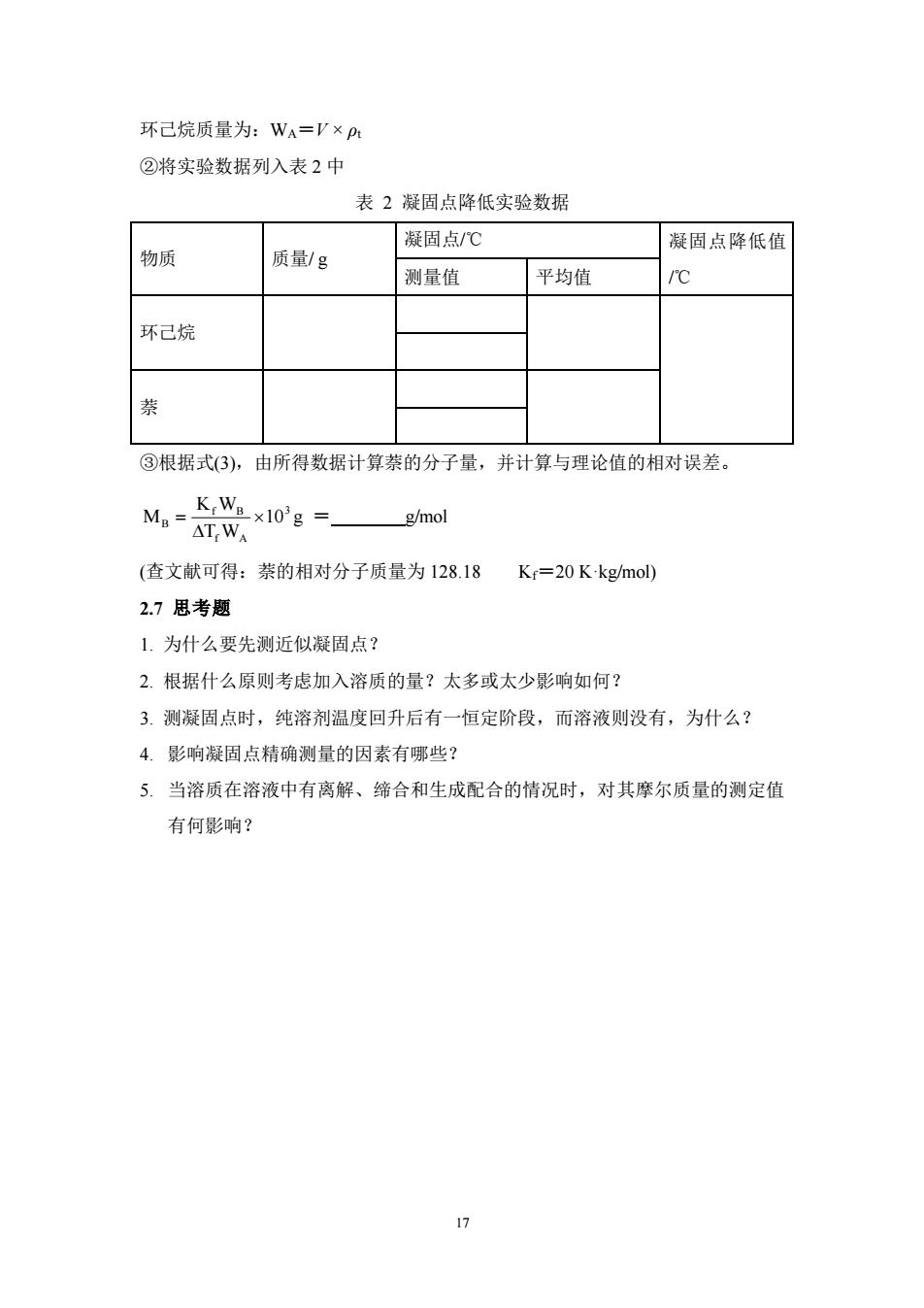
环己烷质量为:WA=V×p: ②将实验数据列入表2中 表2凝固点降低实验数据 凝固点/℃ 凝固点降低值 物质 质量/g 测量值 平均值 /℃ 环己烷 萘 ③根据式(3),由所得数据计算萘的分子量,并计算与理论值的相对误差。 Mg KWg×103g= g/mol △TW (查文献可得:萘的相对分子质量为128.18 Kr=20K·kg/mol) 2.7思考题 1.为什么要先测近似凝固点? 2.根据什么原则考虑加入溶质的量?太多或太少影响如何? 3.测凝固点时,纯溶剂温度回升后有一恒定阶段,而溶液则没有,为什么? 4.影响凝固点精确测量的因素有哪些? 5.当溶质在溶液中有离解、缔合和生成配合的情况时,对其摩尔质量的测定值 有何影响? 4
17 环己烷质量为:WA=V × ρt ②将实验数据列入表 2 中 表 2 凝固点降低实验数据 物质 质量/ g 凝固点/℃ 凝固点降低值 测量值 平均值 /℃ 环己烷 萘 ③根据式(3),由所得数据计算萘的分子量,并计算与理论值的相对误差。 3 f A f B B 10 T W K W M = g = g/mol (查文献可得:萘的相对分子质量为 128.18 Kf=20 K·kg/mol) 2.7 思考题 1. 为什么要先测近似凝固点? 2. 根据什么原则考虑加入溶质的量?太多或太少影响如何? 3. 测凝固点时,纯溶剂温度回升后有一恒定阶段,而溶液则没有,为什么? 4. 影响凝固点精确测量的因素有哪些? 5. 当溶质在溶液中有离解、缔合和生成配合的情况时,对其摩尔质量的测定值 有何影响?

实验3微电脑量热计测定物质的燃烧热 3.1实验目的 1.了解量热计的原理、构造和使用方法,学会用其测定固定试样的燃烧热。 2.学习有关热化学实验的一般知识。 3.了解微机自动操作系统 3.2实验原理 氧弹式量热计,由M.Berthe lot[2于1881年率先报导,时称伯塞洛特(Berthlot bomb)氧弹。目的是测△U、△H等热力学性质。绝热量热法,1905年由Richar 提出。后由Danielst]等人的发展最终被采用。初时通过电加热外筒维持绝热, 并使用光电池自动完成控制外套温度跟踪反应温升进程,达到绝热的目的。现代 实验除了在此基础上发展绝热法外,进而用先进科技设计半自动、自动的夹套恒 温式量热计,测定物质的燃烧热,配以微机处理打印结果。利用雷诺图解法或奔 特公式计算热量计热交换校正值△T。使经典而古老的量热法焕发青春。 1mol物质完全氧化时的反应热称为燃烧热,燃烧产物必须是稳定的终点产 物C02(g)和HO(0等。 公式: 恒容燃烧热 气体总计量系数: ∑n-∑n版 恒压燃烧热 Op=Ov+AnRT (1) 求水当量C及萘的燃烧热Q, 样品质量○ 水的质量和比热 -M O,-gb=(W*C水+C,)AT (2) 样品摩尔质量 铁丝燃烧热及长度 样品燃烧升温值 第一次燃烧,以苯甲酸作为基准物,求水当量C(热量计热容),单位为 JK-1。第二次燃烧,测被测物质萘的恒容燃烧热Q,利用(2.1.1)式再求算Q。 两次升温值都利用雷诺校正图求△T值。或用奔特公式校正△T: 伊
18 实验 3 微电脑量热计测定物质的燃烧热 3.1 实验目的 1. 了解量热计的原理、构造和使用方法,学会用其测定固定试样的燃烧热。 2. 学习有关热化学实验的一般知识。 3. 了解微机自动操作系统 3.2 实验原理 氧弹式量热计,由 M.Berthelot[1][2]于 1881 年率先报导,时称伯塞洛特(Berthlot bomb)氧弹。目的是测U、H 等热力学性质。绝热量热法,1905 年由 Richards 提出。后由 Daniels[3]等人的发展最终被采用。初时通过电加热外筒维持绝热, 并使用光电池自动完成控制外套温度跟踪反应温升进程,达到绝热的目的。现代 实验除了在此基础上发展绝热法外,进而用先进科技设计半自动、自动的夹套恒 温式量热计,测定物质的燃烧热,配以微机处理打印结果。利用雷诺图解法或奔 特公式计算热量计热交换校正值T。使经典而古老的量热法焕发青春。 1mol 物质完全氧化时的反应热称为燃烧热,燃烧产物必须是稳定的终点产 物 CO2(g)和 H2O(l)等。 公式: Qp = QV + nRT (1) 求水当量 CJ 及萘的燃烧热 QV Q qb W C C T M w − V − = ( 水 水 + J ) 样 (2) 第一次燃烧,以苯甲酸作为基准物,求水当量 CJ(热量计热容),单位为 JK−1。第二次燃烧,测被测物质萘的恒容燃烧热 QV,利用(2.1.1)式再求算 Qp。 两次升温值都利用雷诺校正图求T 值。或用奔特公式校正T: 恒容燃烧热 气体总计量系数: n产 −n反 恒压燃烧热 水的质量和比热 样品摩尔质量 样品质量 铁丝燃烧热及长度 样品燃烧升温值