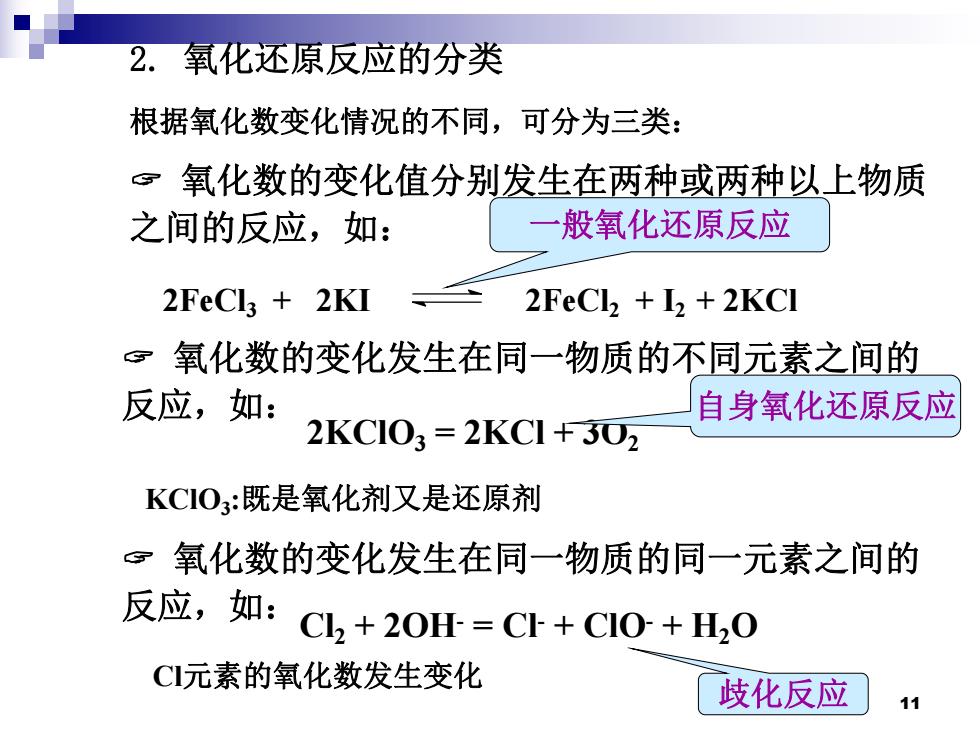
2.氧化还原反应的分类 根据氧化数变化情况的不同,可分为三类: 。氧化数的变化值分别发生在两种或两种以上物质 之间的反应,如: 一般氧化还原反应 2FeCla 2KI 2FeCl,+I2 2KCI ©氧化数的变化发生在同一物质的不同元素之间的 反应,如: 自身氧化还原反应 2KC103=2KC1+302 KCIO3:既是氧化剂又是还原剂 氧化数的变化发生在同一物质的同一元素之间的 反应,如:C,+20=C+CI0+H,0 C元素的氧化数发生变化 歧化反应
11 氧化数的变化发生在同一物质的同一元素之间的 反应,如: 2. 氧化还原反应的分类 根据氧化数变化情况的不同,可分为三类: 氧化数的变化值分别发生在两种或两种以上物质 之间的反应,如: 2FeCl3 + 2KI 2FeCl2 + I2 + 2KCl 一般氧化还原反应 氧化数的变化发生在同一物质的不同元素之间的 反应,如: 2KClO3 = 2KCl + 3O2 自身氧化还原反应 KClO3:既是氧化剂又是还原剂 Cl2 + 2OH- = Cl - + ClO- + H2O 歧化反应 Cl元素的氧化数发生变化

3.氧化还原半反应 ■C2+2KI==2KC+I2 Cl2+2e==2C1 氧化还原半反应 2I-2e==l2 ●氧化还原半反应式中,氧化数较高的物质称 为氧化型物质,氧化数较低的物质称为还原 型。 12
12 3. 氧化还原半反应 n Cl2+2KI==2KCl+I2 Cl2+2e==2Cl - 2I -2e==I2 氧化还原半反应 氧化还原半反应式中,氧化数较高的物质称 为氧化型物质,氧化数较低的物质称为还原 型

4.氧化还原电对 ■同一元素的氧化型和还原型构成的共轭体 系称为氧化还原电对。 用“氧化型/还原型”或“0x/Red”表示。 还原型Reduced Form 氧化型Oxidized Form 13
13 4. 氧化还原电对 n 同一元素的氧化型和还原型构成的共轭体 系称为氧化还原电对。 用“氧化型/还原型”或“Ox/Red”表示。 还原型Reduced Form 氧化型Oxidized Form

例:C2+2KI==2KC+2 Cl2+2e==2C CI2/CI- 2-2e==12 12/- 。氧化还原反应是两个氧化还原电对共同作用的 结果,反应一般按照较强的氧化剂和较强的还 原剂相互作用的方向进行。 14
14 例:Cl2+2KI==2KCl+I2 Cl2+2e==2Cl - Cl2 /Cl - 2I -2e==I2 I2 /I - v 氧化还原反应是两个氧化还原电对共同作用的 结果,反应一般按照较强的氧化剂和较强的还 原剂相互作用的方向进行