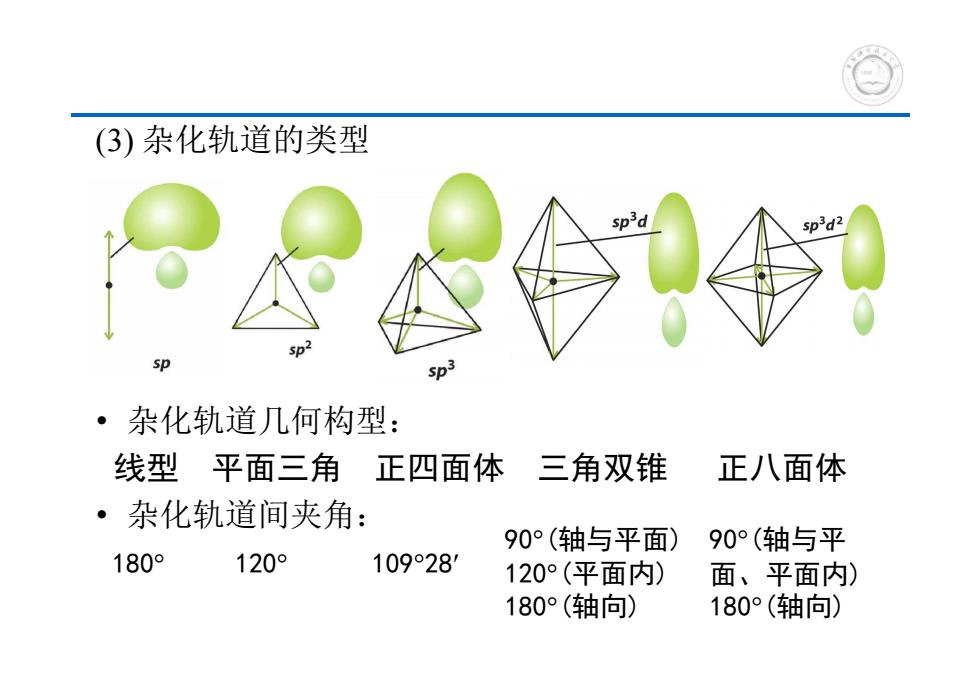
(3)杂化轨道的类型 sp d2 sp ·杂化轨道几何构型: 线型平面三角正四面体 三角双锥 正八面体 ·杂化轨道间夹角: 90°(轴与平面) 90°(轴与平 180° 120° 109°281 120°(平面内) 面、平面内) 180°(轴向) 180°(轴向)
(3) 杂化轨道的类型 • 杂化轨道几何构型: 线型 平面三角 正四面体 三角双锥 正八面体 • 杂化轨道间夹角: 180 120 10928 90(轴与平面) 120(平面内) 180(轴向) 90(轴与平 面、平面内) 180(轴向)

> 等性杂化和不等性杂化 。 等性杂化:每个杂化轨道所含成分完全相同 √例如CH4,C的4个sp杂化轨道都是单电子 ·不等性杂化:杂化轨道所含的成分不完全相同 √例如: H20 NH; √其中O和N的sp杂化轨道上有孤对电子 √孤对电子对成键电子排斥大,导致成键电子键角变小 √H,O中∠HOH=104.5°;NH,中∠HNH=107.3° 22
等性杂化和不等性杂化 • 等性杂化:每个杂化轨道所含成分完全相同 例如CH4,C的4个sp3杂化轨道都是单电子 • 不等性杂化:杂化轨道所含的成分不完全相同 例如: 其中O和N的sp3杂化轨道上有孤对电子 孤对电子对成键电子排斥大,导致成键电子键角变小 H2O中∠HOH = 104.5;NH3中∠HNH = 107.3 H2O NH3 22

>只有已知分子几何构型,才能确定中心原子杂化类型 ·例:BF,和NF √BF,为平面三角形,B原子采取sp杂化 √NF,为三角锥型,N原子采取sp3杂化 >同一中心原子在不同共价分子中可取不同的杂化类型 ·P原子:PCL3(三角锥)sp3,PCL(三角双锥)Sp3d PCl4+(正四面体)sp?PCl6(正八面体)Spd2 ·C原子:C2H6(sp3)、C2H4(sp)、C2H2(sp) ·N原子:HN,和N?中的3个N各采取什么杂化? >如何推测共价分子的几何构型? 23
只有已知分子几何构型,才能确定中心原子杂化类型 • 例:BF3和NF3 BF3 为平面三角形,B原子采取sp2杂化 NF3 为三角锥型,N原子采取sp3杂化 同一中心原子在不同共价分子中可取不同的杂化类型 • P原子:PCl3 (三角锥) , PCl5 (三角双锥) PCl4+ (正四面体) ,PCl6 (正八面体) • C原子:C2H6 (sp3)、C2H4 (sp2)、C2H2 (sp) • N原子:HN3和N3中的3个N各采取什么杂化? 如何推测共价分子的几何构型? sp3 sp3d sp3 sp3d2 23

6.价层电子对互斥理论(Valence Shell Electron Pair Repulsion) (1)基本思想:在共价分子或共价型离子中 >中心原子周围价层电子对尽可能远离,以使斥力最小 ·价层电子对:包括成键电子对和孤对电子对 ·尽可能采用使之本身受到的静电排斥最小的理想几何构型 The best arrangement of a given number of electron pairs is the one that minimizes the repulsion among them (2)判断几何构型的步骤:共价分子/离子记为AB,Em a.确定中心原子A的杂化类型 >即确定A的杂化轨道数或价层电子对数(n+m) ·n:所有与A直接相连的配位原子B的数目 √须考虑中心原子A的价电子数与最多成键数相一致 24
6.价层电子对互斥理论 (Valence Shell Electron Pair Repulsion) (1) 基本思想:在共价分子或共价型离子中 中心原子周围价层电子对尽可能远离,以使斥力最小 • 价层电子对:包括成键电子对和孤对电子对 • 尽可能采用使之本身受到的静电排斥最小的理想几何构型 • The best arrangement of a given number of electron pairs is the one that minimizes the repulsion among them. (2) 判断几何构型的步骤:共价分子/离子记为 ABnEm a. 确定中心原子A的杂化类型 即确定A的杂化轨道数或价层电子对数(n + m) • n :所有与A直接相连的配位原子B的数目 须考虑中心原子A的价电子数与最多成键数相一致 24
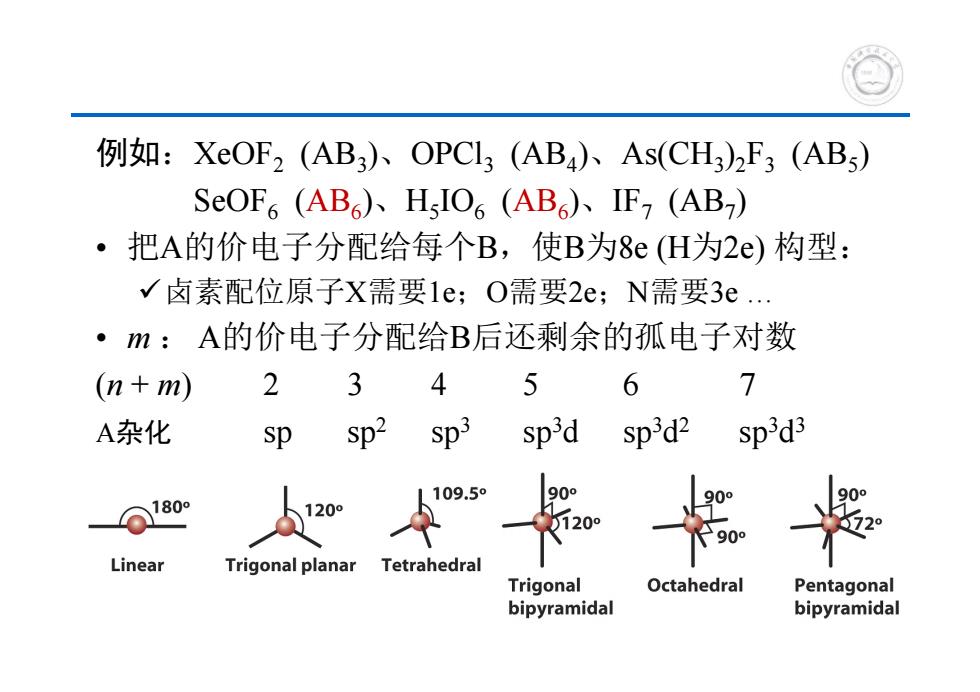
例如:XOF2(AB3)、OPCL3(AB4)、As(CH3)2F3(AB) SeOF6(AB6)、HIO6(AB6)、IF7(AB) ·把A的价电子分配给每个B,使B为8e(H为2e)构型: √卤素配位原子X需要1e;O需要2e;N需要3e. ·m:A的价电子分配给B后还剩余的孤电子对数 (n+m) 2 3 5 6 7 A杂化 sp Sp2 Sp3 sp3d sp3d2 sp3d3 09.59 6180 i20 90。 Linear Trigonal planar Tetrahedral Trigonal Octahedral Pentagonal bipyramidal bipyramidal
例如:XeOF2 (AB3)、OPCl3 (AB4)、As(CH3)2F3 (AB5) SeOF6 (AB6)、H5IO6 (AB6)、IF7 (AB7) • 把A的价电子分配给每个B,使B为8e (H为2e) 构型: 卤素配位原子X需要1e;O需要2e;N需要3e . • m : A的价电子分配给B后还剩余的孤电子对数 (n + m)234 5 6 7 A杂化 sp sp2 sp3 sp3d sp3d2 sp3d3