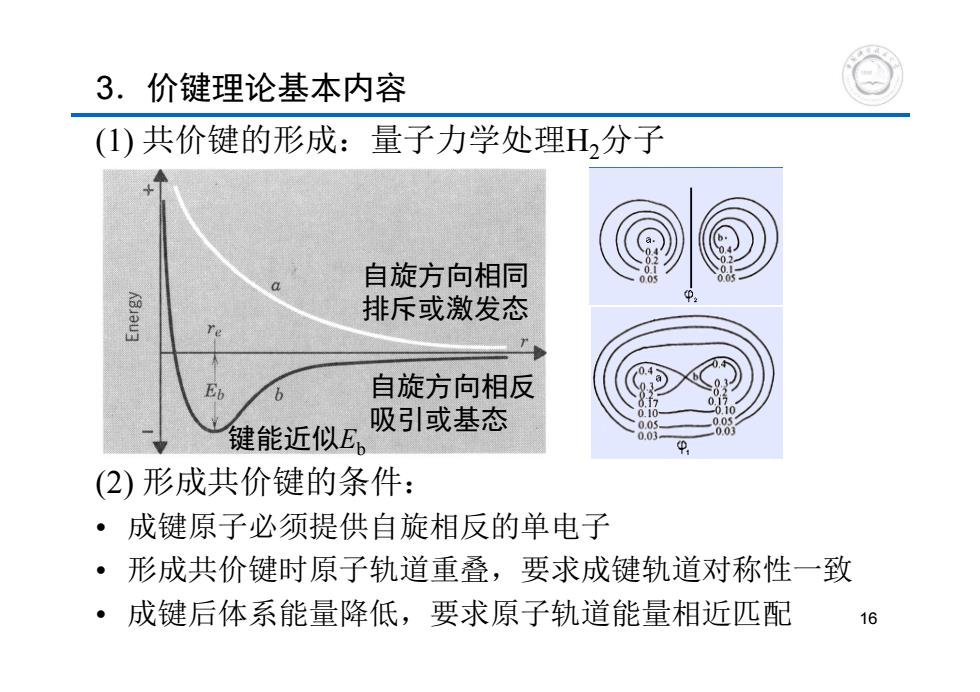
3.价键理论基本内容 (1)共价键的形成:量子力学处理H,分子 自旋方向相同 排斥或激发态 E b 自旋方向相反 吸引或基态 键能近似E (2)形成共价键的条件: ·成键原子必须提供自旋相反的单电子 ·形成共价键时原子轨道重叠,要求成键轨道对称性一致 成键后体系能量降低,要求原子轨道能量相近匹配 16
3.价键理论基本内容 (1) 共价键的形成:量子力学处理H2分子 (2) 形成共价键的条件: • 成键原子必须提供自旋相反的单电子 • 形成共价键时原子轨道重叠,要求成键轨道对称性一致 • 成键后体系能量降低,要求原子轨道能量相近匹配 自旋方向相同 排斥或激发态 自旋方向相反 吸引或基态 键能近似Eb 16
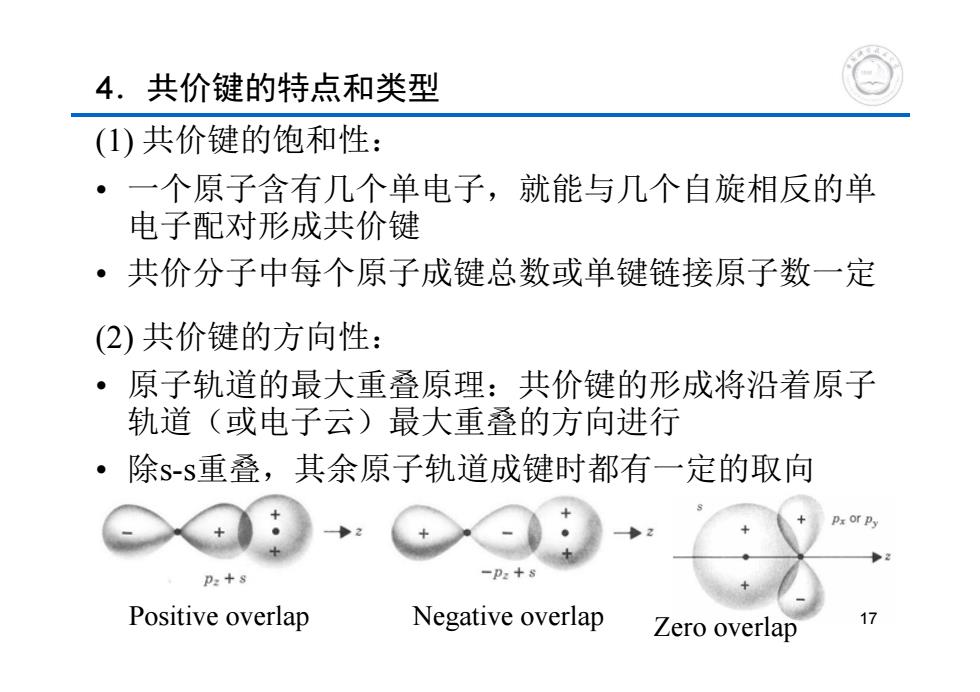
4.共价键的特点和类型 (1)共价键的饱和性: ·一个原子含有几个单电子,就能与几个自旋相反的单 电子配对形成共价键 ·共价分子中每个原子成键总数或单键链接原子数一定 (2)共价键的方向性: ·原子轨道的最大重叠原理:共价键的形成将沿着原子 轨道(或电子云)最大重叠的方向进行 ·除s-s重叠,其余原子轨道成键时都有一定的取向 Px or py p:+8 Positive overlap Negative overlap Zero overlap 17
4.共价键的特点和类型 (1) 共价键的饱和性: • 一个原子含有几个单电子,就能与几个自旋相反的单 电子配对形成共价键 • 共价分子中每个原子成键总数或单键链接原子数一定 (2) 共价键的方向性: • 原子轨道的最大重叠原理:共价键的形成将沿着原子 轨道(或电子云)最大重叠的方向进行 • 除s-s重叠,其余原子轨道成键时都有一定的取向 Positive overlap Negative overlap Zero overlap 17

(3)共价键的类型:根据原子轨道重叠部分所具对称性 ①σ键:沿着键轴方向“头碰头” p:+ ②π键:原子轨道以“肩碰肩”的方式发生重叠 ③δ键:“面对面” 18
(3) 共价键的类型:根据原子轨道重叠部分所具对称性 ① σ 键:沿着键轴方向“头碰头” ② π 键:原子轨道以“肩碰肩”的方式发生重叠 ③ δ 键:“面对面” 18

5.杂化轨道理论(ybrid orbital theory) (1)问题的提出: o 原子单电子数量和轨道方向与形成共价分子后不一致 ?饱和性:基态C原子只有2个单电子,形成CH4分子? ?方向性:O的2p、2p,轨道垂直,H20中∠HOH=104.5°? (2)Pauling杂化轨道理论: >杂化:同一原子中,能量相近的不同类型原子轨道重 新组合,成为一组能量相等的新原子轨道的过程 √丰富和发展价键理论,解释多原子分子空间构型 √增强化学键强度和数量,利于体系能量降低 √解决了共价键的方向性和饱和性 19
5.杂化轨道理论 (Hybrid orbital theory) (1) 问题的提出: • 原子单电子数量和轨道方向与形成共价分子后不一致 饱和性:基态C原子只有2个单电子,形成CH4分子? 方向性:O的2px、2py轨道垂直,H2O中∠HOH = 104.5 ? (2) Pauling 杂化轨道理论: 杂化:同一原子中,能量相近的不同类型原子轨道重 新组合,成为一组能量相等的新原子轨道的过程 丰富和发展价键理论,解释多原子分子空间构型 增强化学键强度和数量,利于体系能量降低 解决了共价键的方向性和饱和性 19
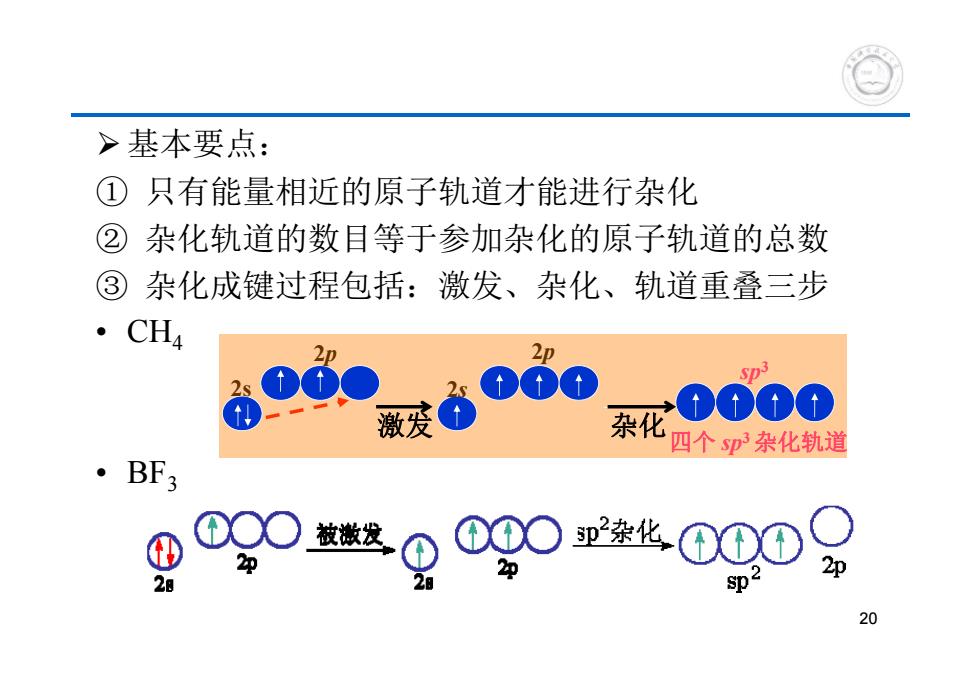
>基本要点: ①只有能量相近的原子轨道才能进行杂化 ②杂化轨道的数目等于参加杂化的原子轨道的总数 ③杂化成键过程包括:激发、杂化、轨道重叠三步 。CH4 激发 -0000 。BF3 杂化四个p杂化轨道 2 数。090业0009 20
基本要点: ① 只有能量相近的原子轨道才能进行杂化 ② 杂化轨道的数目等于参加杂化的原子轨道的总数 ③ 杂化成键过程包括:激发、杂化、轨道重叠三步 • CH4 • BF3 2p 2s 2s 2p sp3 四个 sp3 杂化轨道 激发 杂化 20