
氧化还原反应滴定进行的条件 定量进行:T≥99.9% n1=n2=n=1 01+R2=R1+02 问题 Co2CRL n1=n2=n=2 lg K'=Ig △E≥? Co2CL 99. 2=103 0. n1=1,n2=2,n=2 CR2 Coi gK≥lg(103×103)=6 △E°≥? Ig K'=Al 0.059 ≥6 答案 △E°≥6×0.059=0.36v
11 氧化还原反应滴定进行的条件 n1 = n2 = n = 1 O1 + R2 = R1 + O2 2 1 2 1 lg ' lg R O O R C C C C K = 定量进行: T 99.9% 3 1 1 2 2 10 0.1 99.9 = = O R R O C C C C lg ' lg(10 10 ) 6 3 3 K = 6 0.059 lg ' ' = E K 6 0.059 0.36v ' = E n1 = n2 = n = 2 ? ' E n1 = 1, n2 = 2, n = 2 ? ' E 问题 答案

推导 l1=2=n=1 l1=2=n=2 n1=1,n2=2,n=2 01+R2=R1+02 01+R2=R1+O2 201+R2=2R1+02 K-lgCo2CRL lg K'=lg- CR2Co1 CR2 Co2 CRL≥ 99=103 星 CR2 Cor 0. gK≥lg(103×103)=6 Ig K'=AE △E°×2≥6 0.059 ≥6 Ig K'= lgK≥9 0.059 E°≥6×0.059=0.36v△E°≥0.18v △E°≥0.27v
12 推导 n1 = n2 = n = 1 O1 + R2 = R1 + O2 2 1 2 1 lg ' lg R O O R C C C C K = 3 1 1 2 2 10 0.1 99.9 = = O R R O C C C C lg ' lg(10 10 ) 6 3 3 K = 6 0.059 lg ' ' = E K 6 0.059 0.36v ' = E n1 = n2 = n = 2 O1 + R2 = R1 + O2 同 左 6 0.059 2 lg ' ' = E K 0.18v ' E 2O1 + R2 = 2R1 + O2 n1 = 1, n2 = 2, n = 2 2 1 1 2 2 lg ' lg ( ) O R R O C C C C K = lg K' 9 0.27v ' E

7.14化学计量点时反应进行的程度 化学计量点时,反应进行的程度可以由产物与反应物 Co2 CRI 浓度的比值来表示,该比值可根据平衡常数求得。 CR2 例:计算在1mol/LHCI介质中Fe3+与Sn2+反 应的平衡常数及化学计量点时反应进行的程度。 Sn2+2Fe3+Sn4+2Fe2+ K' 解 1mol/LHC中,E°■ Fe(四/Fe(⑩=0.70gE Sn(IV)/Sn(ID) = 0.14y g'= △En_(0.70-0.14)× 0.059 2=18.98 化学计量点时, 0.059 e(Csw g K'=l(Cre(u) Csndv))Cred) CFe(D=2Csn(IV) CFe()3 CFeQID=2Csn(D) CFe(ID)3 K'二(CFeW 得 -10883=106.232 CFe() T>99.99% 13
13 7.1.4化学计量点时反应进行的程度 化学计量点时,反应进行的程度可以由产物与反应物 浓度的比值来表示,该比值可根据平衡常数求得。 例:计算在1 mol / L HCl 介质中Fe3+ 与Sn2+ 反 应的平衡常数及化学计量点时反应进行的程度。 + + + + + = + 2 3 4 2 解 S n 2F e S n 2F e 1 mol/L HCl 中, E°´ Fe(III)/Fe(II) = 0.70v, E°´ Sn(IV)/Sn(II) = 0.14v 0.059 lg ' ' E n K = 18.98 0.059 (0.70 0.14) 2 = − = lg ' lg( ) ( ) Sn(II) 2 Sn(IV) Fe(III) Fe(II) C C C C K = 化学计量点时, CFe(II) = 2CSn(IV) CFe(III)= 2CSn(II) 3 Fe(III) Fe(II) lg( ) C C = 3 Fe(III) Fe(II) ' ( ) C C K = 得 1 8.9 8/ 3 Fe(III) Fe(II) =10 C C 6.32 =10 T > 99.99% 1 1 2 2 O R R O C C C C , K′
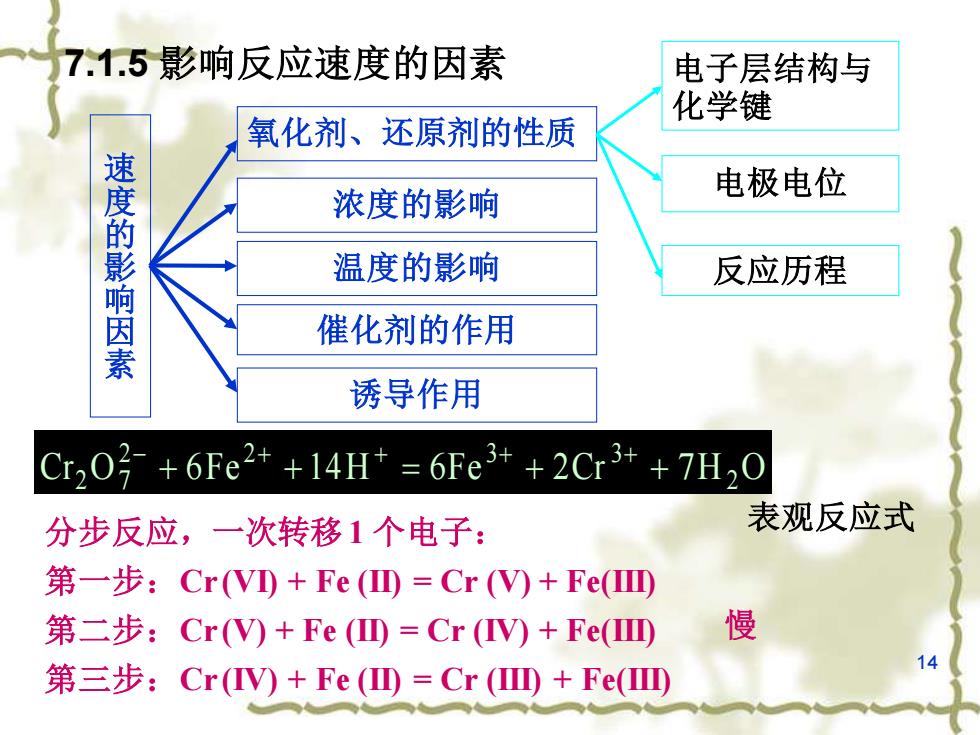
7.1.5影响反应速度的因素 电子层结构与 化学键 氧化剂、还原剂的性质 电极电位 速度的影响因素 浓度的影响 温度的影响 反应历程 催化剂的作用 诱导作用 Cr20号+6Fe2++14H=6Fe3++2Cr3++7H0 分步反应,一次转移1个电子: 表观反应式 第一步:Cr(VD+Fe(⑩=Cr()+Fe(四 第二步:Cr(V)+Fe(⑩=Cr(V)+Fe(四 慢 第三步:Cr(V)+Fe(四=Cr(四+Fe(四
14 7.1.5 影响反应速度的因素 速 度 的 影 响 因 素 氧化剂、还原剂的性质 浓度的影响 温度的影响 催化剂的作用 诱导作用 电子层结构与 化学键 电极电位 反应历程 表观反应式 Cr O 6F e 1 4H 6Fe 2Cr 7H 2 O 2 2 3 3 2 7 + + = + + − + + + + 分步反应,一次转移1 个电子: 第一步:Cr (VI) + Fe (II) = Cr (V) + Fe(III) 第二步:Cr (V) + Fe (II) = Cr (IV) + Fe(III) 第三步:Cr (IV) + Fe (II) = Cr (III) + Fe(III) 慢

【一)浓度对反应速度的影响 一般说来,反应物浓度越大,反应速 度越快,对于有H+参加的反应,提高酸度 也能加速反应。例如: C20房+6I+14H+=2Cx3++32+7H20 此反应速度较慢,通常采用增大的浓 度(KI过量约5倍)和提高溶液的酸度(约 0.4mol/L)来加快反应,只需3~5mim,反 应就能进行完全。 15
15 (一)浓度对反应速度的影响 一般说来,反应物浓度越大,反应速 度越快,对于有H+参加的反应,提高酸度 也能加速反应。例如: 此反应速度较慢,通常采用增大I -的浓 度(KI过量约5倍)和提高溶液的酸度(约 0.4mol/L)来加快反应,只需3~5min,反 应就能进行完全