
注意: 1)n: 电对的电子转移数 2)E:标准电极电位,温度的函数,t=25℃时, [MnO4]=[H]=Mn2+=1mol/L时的特定条件,可查表, 判断氧化剂和还原剂的强弱. 结论: 1)电对的E高, 其氧化型的氧化能力强,可氧化电位比它 低的还原剂. 2)电对的低,其还原型的还原能力强,可还原电位比它 高的氧化剂. 3)E随H而改变,随cox和ce而变化
6 注意: 1)电对的 高,其氧化型的氧化能力强,可氧化电位比它 低的还原剂. 0 E 2) :标准电极电位,温度的函数,t=25℃时, [MnO4 2- ]=[H+ ]=[Mn2+ ]=1mol/L时的特定条件,可查表, 判断氧化剂和还原剂的强弱. 0 E 1) n:电对的电子转移数 结论: 2)电对的 低,其还原型的还原能力强,可还原电位比它 高的氧化剂. 0 E 3)E随[H+ ]而改变,随 cOX和 cRed而变化.

7.1.2条件电位 氧化态与还原态的活度 0.059 a(Ox) E=E°+ 1 (25°C) n a(Re a(Ox)=Yo[O] YoColao a(Re)=YR[R]=YRCR/aR 代入,得 E=E°+00591g 0.059 n RQO n R 当Co=CR=1mol/L时,得 E=E°+ 0.0591g n YRQO E°'一条件电位 例题
7 (25 ) (Re) (O ) lg 0.059 C a a x n E E = + 7.1.2 条件电位 (O ) [O] O a x = O O O = C / (Re) [R] R a = R R R = C / 代入,得 R O R O O R C C n n E E lg 0.059 lg 0.059 = + + 当 CO = CR = 1 mol / L 时,得 R O O R n E E lg ' 0.059 = + E°´— 条件电位 氧化态与还原态的活度 例题

例题计算1mo/LHC1溶液中,C(Ce4+)=1.00×102moL, C(Ce3+)=1.00x103mol/L时,Ce4+/Ce3+电对的电位。 解 =E°+0.0591g7o0R,0098U n 0.059 特定条件下E=E+ n R 查条件电位表1mol/LHC1溶液中,E。=1.28 Cce(Iv) E=E°+0.059gCce0 =1.28+0.059l 1.0×10-2 1.0×10-3 E=1.34y
8 例题 R O R O O R C C n n E E lg 0.059 lg 0.059 = + + 计算1 mol/L HCl 溶液中,C(Ce4+) = 1.0010-2 mol/L, C(Ce3+) = 1.0010-3 mol/L时, Ce4+ / Ce3+电对的电位。 解 查条件电位表 1 mol/L HCl 溶液中,E°´=1.28 (III) ' (I V) lg 1 0.059 Ce Ce C C E = E + 3 2 1.0 10 1.0 10 1.28 0.059 lg − − = + E =1.34v 特定条件下 R O C C n E E lg 0.059 = '+

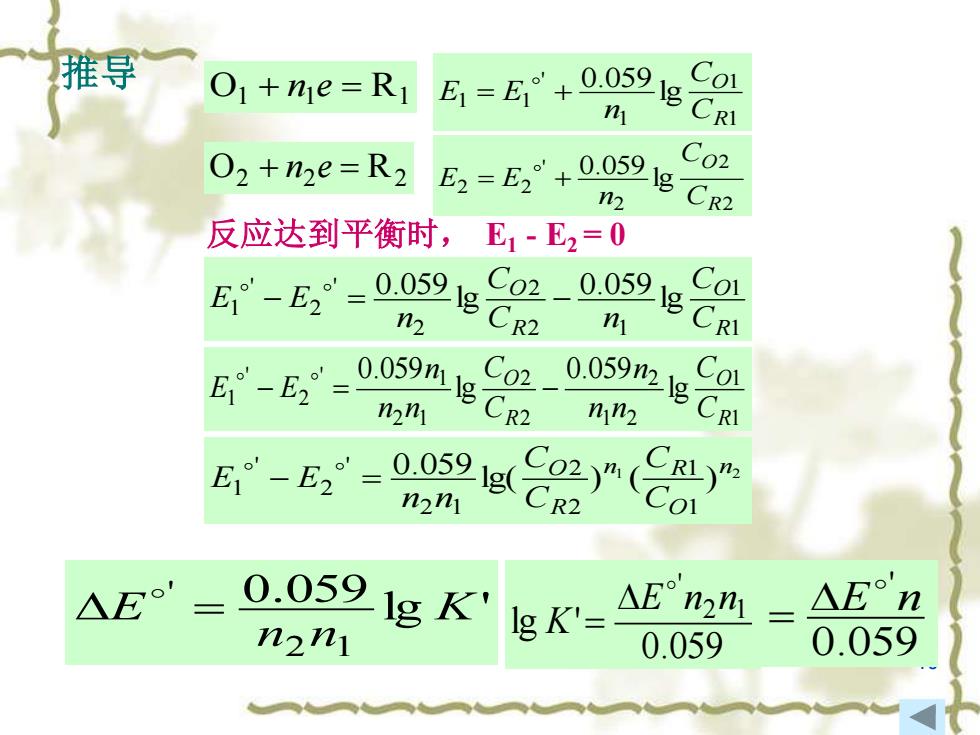
7.1.3平衡常数、条件平衡常数 设氧化还原反应为: n201+nR2=n2R1+n102 lg K'=1g( 02 有关氧化还原电对的半反应 R2 O1+ne=R1 =E E +0.059 n为两电对得失 n 电子的最小公倍 02+n2e=R2 0.0591gCR2 02 数,也即氧化还 原反应实际上的 反应达到平衡时,E1-E2=0 推导 转移的电子数。 △E'= 0.0591 1g K' n2nl n1=2=1,n=1 n1=2,m2=3,n=6 IgK'= △E°2n= △En 0.059 0.059 同理:gK= △E°n 9 0.059
9 7.1.3平衡常数、条件平衡常数 设氧化还原反应为: 2 O1 1 R 2 2 R1 1 O 2 n + n = n + n 1 2 lg ' lg( ) ( ) 1 1 2 2 n O n R R O C C C C K = 有关氧化还原电对的半反应 O1 + 1 = R1 n e O2 + 2 = R 2 n e 1 1 1 ' 1 1 lg 0.059 R O C C n E = E + 2 2 2 ' 2 2 lg 0.059 R O C C n E = E + 反应达到平衡时, E1 - E2 = 0 lg ' 0.059 2 1 ' K n n E = 0.059 lg ' 2 1 ' E n n K = 0.059 ' E n = n为两电对得失 电子的最小公倍 数,也即氧化还 原反应实际上的 转移的电子数。 n1 = n2 = 1, n = 1 n1 = 2, n2 = 3, n = 6 同理: 0.059 lg E n K = 推导
推导 O1+me=R1 E=E°'+0.059s n 02+n2e=R2 E2=E2°+00591 C02 n2 CR2 反应达到平衡时,E1-E2=0 -6008c网 n2 C020.0591g/ n C E=E°、0.059g℃0 Co nn 2-0059mg nn E°-E2° 0.059g(CR2 n2n △E'= 0.0591 1g K' n2n g K'= E°n2h1= △E'n 0.059 0.059
10 推导 O1 + 1 = R1 n e O2 + 2 = R2 n e 1 1 1 ' 1 1 lg 0.059 R O C C n E = E + 2 2 2 ' 2 2 lg 0.059 R O C C n E = E + 反应达到平衡时, E1 - E2 = 0 1 1 2 1 2 2 ' 2 ' 1 lg 0.059 lg 0.059 R O R O C C C n C n E − E = − 1 1 1 2 2 2 2 2 1 ' 1 2 ' 1 lg 0.059 lg 0.059 R O R O C C n n n C C n n n E − E = − 1 2 lg( ) ( ) 0.059 1 1 2 2 2 1 ' 2 ' 1 n O n R R O C C C C n n E − E = lg ' 0.059 2 1 ' K n n E = 0.059 lg ' 2 1 ' E n n K = 0.059 ' E n =