
6.4络合滴定法的基本原理 络合滴定与酸碱滴定 强酸滴定弱碱 平衡常数 滴定反应 A+H=HA 络合滴定反应M!+Y'=MY Kt=KMY
1 络合滴定与酸碱滴定 强酸滴定弱碱 滴定反应 A H HA - + = + a t 1 K K = 平衡常数 络合滴定反应 M + Y = MY Kt KMY = 6.4 络合滴定法的基本原理
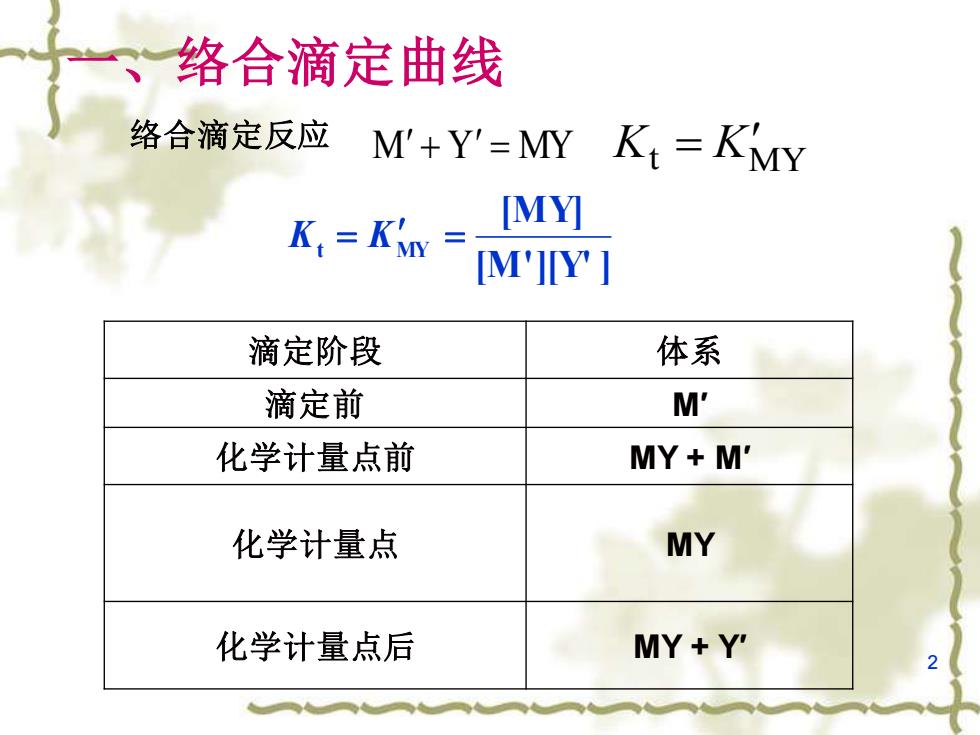
络合滴定曲线 络合滴定反应 M'+Y'=MY Kt=KMY [MY] M'JY 滴定阶段 体系 滴定前 M' 化学计量点前 MY+M' 化学计量点 MY 化学计量点后 MY+Y
2 一、络合滴定曲线 滴定阶段 体系 滴定前 M′ 化学计量点前 MY + M′ 化学计量点 MY 化学计量点后 MY + Y′ [M'][Y' ] [MY] Kt = KMY = 络合滴定反应 M + Y = MY Kt KMY =

[例1pH=9.0,0.01000mol/L的EDTA滴定20.00mL, 0.01000mol/L的Zn2+(IgKzny-16.5,pH-=9.0,lgvm=1.28, gzom-0.2) [解] Ig K'znY=Ig KznY-lg dzn-lg ay =15.02 1、滴定前 pZn'=-lg[Zn']=-Ig CZn =2.00 2、sp前 [Zn]=(cV)zn-(cV)y VZn+Vy 加入19.98 ml EDTA pZm'=5.30 3
3 [例] pH=9.0,0.01000mol/L的EDTA滴定20.00mL, 0.01000mol/L的Zn2+( lgKZnY=16.5, pH=9.0, lgαY(H)=1.28, lgαZn(OH)=0.2 ) [解] lg K' ZnY = lg KZnY −lgZn −lg Y =15.02 1、滴定前 pZn'= −lg[Zn'] = −lgCZn = 2.00 2、sp前 Zn Y ( ) Zn ( ) Y [Zn'] V V cV cV + − = 加入19.98ml EDTA pZn =5.30
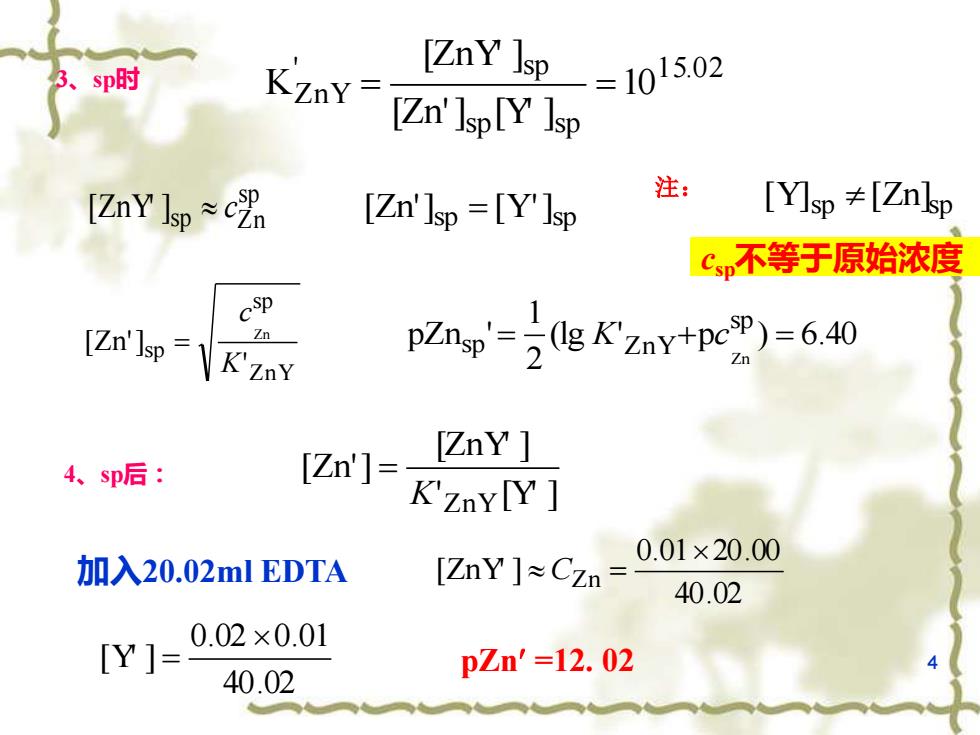
、sp时 [ZnY Isp 3 _=1015.02 [Zn']sp[Y Isp [ZnY Isp≈c 注: [Zn']sp=[Y]sp [Y]sp [Znlsp Cp不等于原始浓度 cSp [Zn'Isp=K'ZnY Z pZnw-(ny+po).40 [Zn]- [ZnY 4、sp后: K'zny[Y 加入20.02 ml EDTA [ZnY]≈Czn= 0.01×20.00 40.02 [Y]= 0.02×0.01 40.02 pZn'=12.02
4 3、sp时 1 5.0 2 sp sp ' sp ZnY 10 [Zn'] [Y' ] [ZnY' ] K = = csp不等于原始浓度 (lg ' p ) 6.40 2 1 pZn ' sp sp ZnY Zn = K + c = sp sp Zn [ZnY' ] c sp sp [Zn'] = [Y'] ZnY sp sp ' [Zn'] Zn K c = 注: sp sp [Y] [Zn] 4、sp后: ' [Y' ] [ZnY' ] [Zn'] K ZnY = 加入20.02ml EDTA 40.02 0.01 20.00 [ZnY' ] Zn C = 40.02 0.02 0.01 [Y' ] = pZn =12. 02
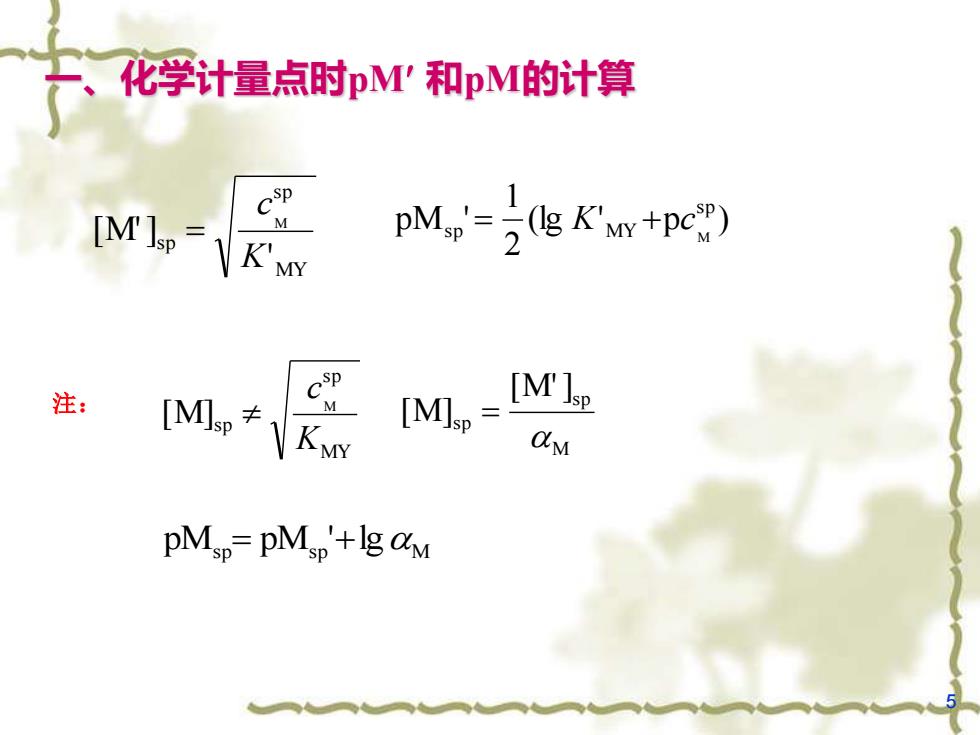
、 化学计量点时pM'和pM的计算 [M NK'MY PM.'=K+p) 注: [M≠KN M [MI= ']p dM pMsp=pMs+g aM
5 一、化学计量点时pM 和pM的计算 (lg ' p ) 2 1 pM ' s p s p MY M = K + c MY sp sp ' [M'] M K c = 注: MY sp sp M] M [ K c M sp sp [M'] [M] = pMsp = pMsp '+lg M